Hukum, Sistem, dan Proses Termodinamika Lengkap
Pengertian Termodinamika
Berdasarkan bahasa Termodinamika berasal dari kata thermos yang berarti panas dan dynamic yang berati gerak atau perubahan. Termodinamika termasuk kedalam salah satu cabang dari ilmu fisika yang mempelajari panas dan temperatur, serta hubungan keduanya pada energi dan gerak. Inti dari pembahasan termodinamika adalah bagaimana energi dalam bentuk panas dapat mengalir dari satu benda ke benda lain, proses dari aliran energi tersebut, dan akibat yang dihasikan oleh perpindahan energi tersebut.
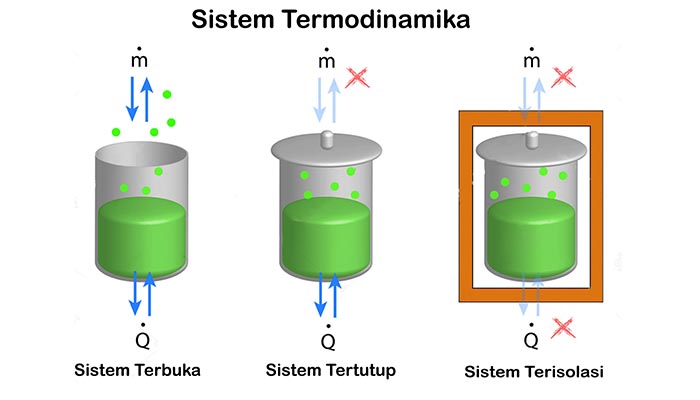
Sistem Termodinamika
Klasifikasi sistem termodinamika berdasarkan sifat dari batasan dan arus benda, energi dan materi yang melaluinya terbagi atas tiga jenis sistem. berdasarkan jenis pertukaran yang terjadi antara sistem dan lingkungannya, yaitu :
1) Sistem terbuka
Sistem yang mengakibatkan terjadinya pertukaran energi (panas dan kerja) dan benda (materi) dengan lingkungannya. Sistem terbuka ini meliputi peralatan yang melibatkan adanya aliran massa kedalam atau keluar sistem seperti pada kompresor, turbin, nozel dan motor bakar.
Sistem mesin motor bakar adalah ruang didalam silinder mesin, dimana campuran bahan bahan bakar dan udara masuk kedalam silinder, dan gas buang keluar sistem. Pada sistem terbuka ini, baik massa maupun energi dapat melintasi batas sistem yang bersifat permeabel. Dengan demikian, pada sistem ini volume dari sistem tidak berubah sehingga disebut juga dengan control volume.
Baca juga: Kapasitas Kalor Gas
Kesepakatan yang kita gunakan untuk menganalisis sistem disini yaitu
- Untuk panas (Q) bernilai positif bila diberikan kepada sistem dan bernilai negatif bila keluar dari sistem
- Untuk usaha (W) bernilai positif apabila keluar dari sistem dan bernilai negatif bila diberikan (masuk) kedalam sistem.
2) Sistem tertutup
Sistem yang mengakibatkan terjadinya pertukaran energi (panas dan kerja) tetapi tidak terjadi pertukaran zat dengan lingkungan. Sistem tertutup terdiri atas suatu jumlah massa yang tertentu dimana massa ini tidak dapat melintasi lapis batas sistem. Tetapi, energi baik dalam bentuk panas (heat) maupun usaha (work) dapat melintasi lapis batas sistem tersebut.
Dalam sistem tertutup, meskipun massa tidak dapat berubah selama proses berlangsung, namun volume dapat saja berubah disebabkan adanya lapis batas yang dapat bergerak (moving boundary) pada salah satu bagian dari lapis batas sistem tersebut. Contoh sistem tertutup adalah suatu balon udara yang dipanaskan, dimana massa udara didalam balon tetap, tetapi volumenya berubah dan energi panas masuk kedalam masa udara didalam balon.
Sebagaimana gambar sistem tertutup dibawah ini, apabila panas diberikan kepada sistem (Qin), maka akan terjadi pengembangan pada zat yang berada didalam sistem. Pengembangan ini akan menyebabkan piston akan terdorong ke atas (terjadi Wout). Karena sistem ini tidak mengizinkan adanya keluar masuk massa kedalam sistem (massa selalu konstan) maka sistem ini disebut control massa.
Tonton video
Termodinamika (Part 1) || Hukum 1 Termodinamika Lengkap dengan Contoh Soal
Suatu sistem dapat mengalami pertukaran panas atau kerja atau keduanya, biasanya dipertimbangkan sebagai sifat pembatasnya:
- Pembatas adiabatik: tidak memperbolehkan pertukaran panas.
- Pembatas rigid: tidak memperbolehkan pertukaran kerja.
Dikenal juga istilah dinding, ada dua jenis dinding yaitu dinding adiabatik dan dinding diatermik. Dinding adiabatik adalah dinding yang mengakibatkan kedua zat mencapai suhu yang sama dalam waktu yang lama (lambat). Untuk dinding adiabatik sempurna tidak memungkinkan terjadinya pertukaran kalor antara dua zat. Sedangkan dinding diatermik adalah dinding yang memungkinkan kedua zat mencapai suhu yang sama dalam waktu yang singkat (cepat).
3) Sistem terisolasi
Sistem yang mengakibatkan tidak terjadinya pertukaran panas, zat atau kerja dengan lingkungannya. Contohnya : air yang disimpan dalam termos dan tabung gas yang terisolasi. Dalam kenyataan, sebuah sistem tidak dapat terisolasi sepenuhnya dari lingkungan, karena pasti ada terjadi sedikit pencampuran, meskipun hanya penerimaan sedikit penarikan gravitasi. Dalam analisis sistem terisolasi, energi yang masuk ke sistem sama dengan energi yang keluar dari sistem.
Karakteristik yang menentukan sifat dari sistem disebut property (koordinat sistem/variabel keadaan sistem), seperti tekanan (p), temperatur (T), volume (v), masa (m), viskositas, konduksi panas dan lain-lain. Selain itu ada juga koordinat sistem yang didefinisikan dari koordinat sistem yang lainnya seperti, berat jenis, volume spesifik, panas jenis dan lain-lain.
Suatu sistem dapat berada pada suatu kondisi yang tidak berubah, apabila masing-masing jenis koordinat sistem tersebut dapat diukur pada semua bagiannya dan tidak berbeda nilainya. Kondisi tersebut disebut sebagai keadaan (state) tertentu dari sistem, dimana sistem mempunyai nilai koordinat yang tetap. Apabila koordinatnya berubah, maka keadaan sistem tersebut disebut mengalami perubahan keadaan. Suatu sistem yang tidak mengalami perubahan keadaan disebut sistem dalam keadaan seimbang (equilibrium).
Baca Juga : Usaha Dalam Termodinamika
Hukum Termodinamika
Pada termodinamika, terdapat 4 hukum yang berlaku secara universal.
-
Hukum Termodinamika 0
Hukum termodinamika 0 berbunyi “Jika dua sistem berada dalam kesetimbangan termal dengan sistem ketiga, maka mereka berada dalam kesetimbangan termal satu sama lain”.
Hukum ini menjelaskan kesetimbangan termal berlaku universal, dengan kata lain apapun zat atau materi benda akan memiliki kesetimbangan termal yang sama bila disatukan.
- Hukum Termodinamika 1
Hukum termodinamika 1 berbunyi “Energi tidak dapat diciptakan ataupun dimusnahkan, melainkan hanya bisa diubah bentuknya saja” menunjukkan hukum kekekalan energi.
Hukum ini dapat dijelaskan dalam persamaan matematik, yaitu:
keterangan =
= Kalor/panas yang diterima/dilepas (J),
adalah energi/usaha (J),
adalah perubahan energi (J).
Dari persamaan tersebut dapat diketahui bahwa seluruh kalor yang diterima atau dilepas oleh benda akan dijadikan usaha ditambahkan dengan perubahan energi.
-
Hukum Termodinamika 2
Hukum 2 Termodinamika berbunyi “Kalor mengalir secara alami dari benda yang panas ke benda yang dingin; kalor tidak akan mengalir secara spontan dari benda dingin ke benda panas tanpa dilakukan usaha”. Secara implisit hukum ini menunjukkan kondisi alami dari alur kalor suatu objek dengan sistem.
-
Hukum Termodinamika 3
Hukum 3 Termodinamika berbunyi “Entropi dari suatu kristal sempurna pada absolut nol adalah sama dengan nol,”
Baca juga: Contoh Soal dan Pembahasan Tentang Termodinamika
Proses-proses Termodinamika
Proses termodinamika terbagi menjadi empat macam, tergantung dari keadaan tekanan, volume, dan suhu saat terjadinya proses tersebut. Proses-proses tersebut umumnya digambarkan dalam diagram P-V, yaitu diagram yang menggambarkan tekanan (P) dan volume (V) saat proses terjadi. Ada dua hal penting yang harus diingat dari berbagai jenis proses-proses termodinamika, yaitu variabel yang berubah dan usaha yang dilakukan. Usaha yang terjadi pada suatu proses termodinamika dapat diketahui dengan menghitung luasan grafik P-V.
-
Isobarik
Isobarik adalah proses termodinamika yang tidak mengubah nilai tekanan sistem (). Nilai usaha dapat dihitung dengan persamaan berikut.
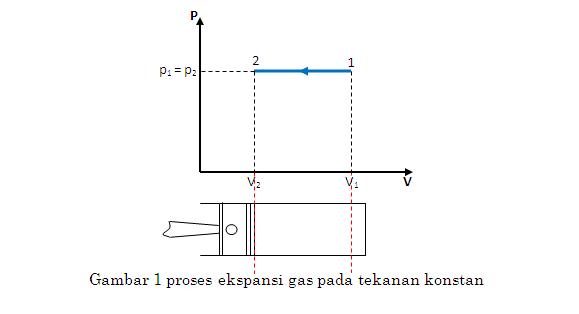
Dari rumus tersebut, diketahui juga bahwa apabila volume membesar (terjadi pemuaian) maka usaha bernilai positif, dan bila volume mengecil (terjadi penyusutan) maka usaha bernilai negatif.
-
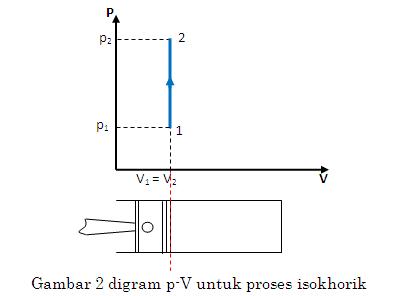
Isokhorik
Isokhorik adalah proses termodinamika yang tidak mengubah nilai volume sistem (). Pada proses ini, nilai usaha adalah 0 karena tidak terdapat suatu luasan bangun yang terdapat pada gambar P-V.
-
Isotermik
Isotermik adalah proses termodinamika yang tidak mengubah nilai suhu sistem ().
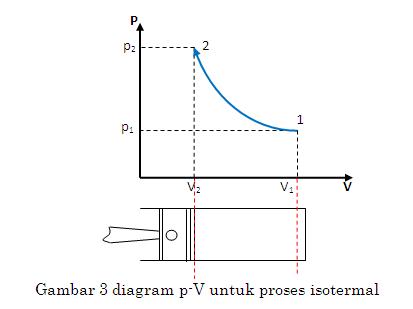
Nilai usaha pada proses isotermik dinyatakan dengan persamaan berikut:
Dimana n adalah jumlah zat yang dinyatakan dengan satuan mol, R adalah konstanta gas, dan T adalah suhu. Rumus ini didapatkan dengan menggabungkan persamaan usaha di diagram P-V dengan persamaan gas ideal.
-
Adibatik
Adiabatik adalah proses termodinamika yang tidak mengubah nilai kalor sistem ().
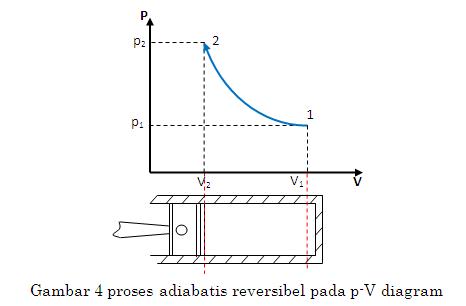
Pada gas monoatomic, usaha yang dilakukan pada proses adiabatik dapat dinyatakan dengan persamaan:
Jika diperhatikan dengan sekilas, proses adiabatik dan isotermik memiliki diagram P-V yang serupa. Secara detil, dapat dilihat bahwa proses adiabatik memiliki kemiringan yang lebih curam dibandingkan proses isotermik seperti contoh grafik berikut.
Artikel Terkait
- Sejumlah gas ideal dipanaskan hingga suhunya 2 kali semula pada tekanan tetap dengan mengambil kalor dari sumber panas sebesar 300 j untuk melakukan kerja sebesar 250 j. selama siklus terjadi besarnya energi dalam yang dikerjakan oleh gas sebesar
- Suatu mesin Carnot, jika reservoir panasnya bersuhu 400 K akan mempunyai efisiensi 40%. Jika reservoir panasnya bersuhu 640 K, efisiensinya menjadi …. %.
- Mesin Carnot bekerja pada suhu tinggi 600 K mempunyai efisiensi 40%. Agar efisiensi mesin naik menjadi 75% dengan suhu reservoir rendah tetap, maka reservoir suhu tinggi harus dinaikkan menjadi ... ?
- Contoh Soal Termodinamika (Fisika SMA) - Go Royong With Agiv
- Hukum 3 Termodinamika (Fisika SMA) - Go Royong With Agiv
- Pengertian Termodinamika
- Contoh Soal dan Pembahasan Teori Kinetik Gas
- Teori Kinetik Gas dan Sifatnya
- Ringkasan Materi Suhu dan Kalor
- Ringkasan Materi Suhu dan Kalor