Teori Kinetik Gas dan Sifatnya

Teori kinetik gas adalah teori yang menggunakan tinjauan tentang gerak dan energi partikel-partikel gas untuk menyelidiki sifat-sifat gas secara keseluruhan sebagai hasil rata-rata kelakuan partikel-partikel gas tersebut. Gas yang ditinjau dalam permasalahan ini adalah gas ideal yaitu gas yang memiliki sifat-sifat:
-
Terdiri atas partikel-partikel yang jumlahnya banyak sekali dan antar partikelnya tidak terjadi gaya tarik-menarik.
-
Setiap partikel gas bergerak dengan arah sembarang
-
Ukuran partikel gas dapat diabaikan terhadap ukuran ruangan.
-
Setiap tumbukan yang terjadi berlangsung secara lenting sempurna.
-
Partikel gas terdistribusi merata dalam seluruh ruangan.
-
Berlaku hukum Newton tentang gerak.
Pada kenyataannya tidak ada gas sejati yang memenuhi sifat-sifat gas ideal, tetapi gas pada suhu kamar dan pada tekanan rendah dapat mendekati sifat-sifat gas ideal.
Penurunan Persamaan Keadaan gas Ideal
Perhatikan sejenis gas ideal yang terdapat dalam suatu bejana silinder. Volum gas ideal ini dapat diubah dengan menggerakkan piston ke atas dan ke bawah (gambar di atas). Anggap bahwa bejana tidak bocor sehingga massa atau banyak mol gas itu tetap. Persamaan keadaan gas ideal kita peroleh dengan dua cara berikut:
Cara pertama, suhu gas dijaga tetap dan vlume diubah-ubah dengan menggerak-gerakan piston. Misalnya, tekanan gas mula-mula p0 dan volume gas mula-mula V0. Jika piston digerakkan ke bawah hingga volume gas berkurang menjadi ½ V0, ternyata tekanan gas bertambah menjadi 2 P0. Jika piston terus digerakkan ke bawah sehingga volume gas berkurang menjadi ¼ V0, ternyata tekanan gas bertambah menjadi 4 P0. Hasil ini dapat disimpulkan oleh pernyataan berikut:
Jika suhu gas yang berada dalam bejana tertutup (tidak bocor) dijaga tetap, tekanan gas berbanding terbalik dengan volumenya.
Secara matematis, pernyataan di atas dinyatakan sebagai:

Persamaan di atas pertama kali dinyatakan oleh Robert Boyle pada tahun 1666, sehingga disebut Hukum Boyle.
Cara kedua, tekanan gas dijaga tetap dan volume gas diubah-ubah dengan mengerakan piston. Diasumsikan suhu mutlak gas mula-mula T0 dan volume gas mula-mula V0. Bila piston digerakkan ke atas sehingga volume gas bertambah menjadi 2 V0, ternyata suhu mutlak gas bertambah menjadi 2 T0. Bila psiton terus digerakan ke atas sehingga volume gas bertambah menjadi 4 V0, ternyata suhu mutlak gas bertambah menjadi 4 T0. Hasil ini disimpulkan dengan pernyataan berikut:
Baca Juga :
Contoh Soal dan Pembahasan Teori Kinetik Gas
Eksperimen Sains Teori Kinetik Gas
Contoh Soal dan Pembahasan Tentang Termodinamika
Jika tekanan gas yang berada dalam bejana tertutup (tidak bocor) dijaga tetap, volume gas sebanding dengan suhu mutlaknya.
Pernyataan di atas secara matematis dinyatakan sebagai
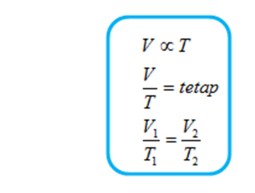
Persamaan di atas dinyatakan pertama kali oleh Jacques Charles (1747 -1823) dan Joseph Gay Lussac (1778 – 1805), dan disebut hukum Charles-gay Lussac.
Data suhu gas lebih sering dinyatakan dalam t0C. Suhu mutlak gas T yang dinyatakan dalam satuan Kelvin (K) dihitung dengan persamaan:
T = t + 273
Sekarang kita dapat menyatakan persamaan gas ideal yang memenuhi hukum Boyle dan Charles-Gay Lussac dengan menyatukan kedua persamaan di atas.

Persamaan di atas dikenal dengan sebutan persamaan Boyle-Gay Lussac. Persamaan ini sebaiknya digunakan untuk menyelesaikan soal-soal suatu gas yang jumlahnya tetap (massanya tetap). Massa suatu gas adalah tetap jika diletakkan dalam suatu wadah yang tidak bocor.
Jika massa atau mol gas diubah, misal kita menggandakan mol gas (n), dengan menjaga tekanan dan suhu tetap , ternyata dihasilkan volume V yang ganda (lipat dua) juga. Karena itu, kita boleh menulis bilangan tetap di ruas kanan. Persamaan dengan nR, dengan R diperoleh dari percobaan, dan kita memperoleh persamaan umum yang berlaku untuk gas ideal, yang disebut persamaan keadaan gas ideal.
pV = nRT
dengan
p = tekanan gas (Pa atau atm)
V = volume gas (m3 atau L)
n = jumlah mol gas
R = tetapan umum gas = 8,314 J/mol K = 0,082 Latm/molK
T = suhu mutlak (K)
Penerapan Teori Kinetik Gas Yang Ada Pada Kehidupan Sehari – Hari
1. Pada saat anda sering menggunakan motor dan motor akan menjadi lebih panas, bukan hanya pada mesin saja yang menjadi lebih panas tapi juga body motor serta ban yang menjadi lebih panas. Ban motor akan lebih sering bersentuhan dengan aspal yang tentu menjadi lebih panas, sehingga suhu ban menjadi meningkat dan akan menjadi lebih panas. Pada saat suhu meningkat otomatis tekanan yang ada di dalam ban juga akan ikut meningkat.
2. Ketika anda memasukkan kopi hangat di dalam botol lalu menutupnya segera maka lama kelamaan suhu akan turun dan menyesuaikan dengan lingkungan yang ada di sekitarnya. Turunnya suhu yang ada pada kopi ini membuat rumus gas ideal mulai bekerja yakni pada saat suhu turun membuat tekanan di dalam botol menjadi turun, hal inilah yang membuat botol kopi menjadi kempes seperti tersedot.