Titrasi Asam Basa
Reaksi penetralan dapat digunakan untuk menetapkan kadar atau konsentrasi suatu larutan asam atau basa. Penetapan kadar suatu larutan ini disebut titrasi asam-basa.
Pengertian titrasi adalah penambahan larutan baku (larutan yang telah diketahui dengan tepat konsentrasinya) ke dalam larutan lain dengan bantuan indikator sampai tercapai titik ekuivalen. Titrasi dihentikan tepat pada saat indikator menunjukkan perubahan warna. Saat perubahan warna indikator disebut titik akhir titrasi (James E. Brady, 1990).
Perubahan pH pada reaksi asam basa - Titrasi Asam Basa
Suatu asam yang mempunyai pH kurang dari 7 jika ditambah basa yang pH–nya lebih dari 7, maka pH asam akan naik, sebaliknya suatu basa jika ditambah asam, maka pH basa akan turun. Apabila penambahan zat dilakukan tetes demi tetes kemudian dihitung pH–nya akan diperoleh kurva titrasi, yaitu grafik yang menyatakan pH dan jumlah larutan standar yang ditambah.
1. Titrasi Asam Kuat oleh Basa Kuat
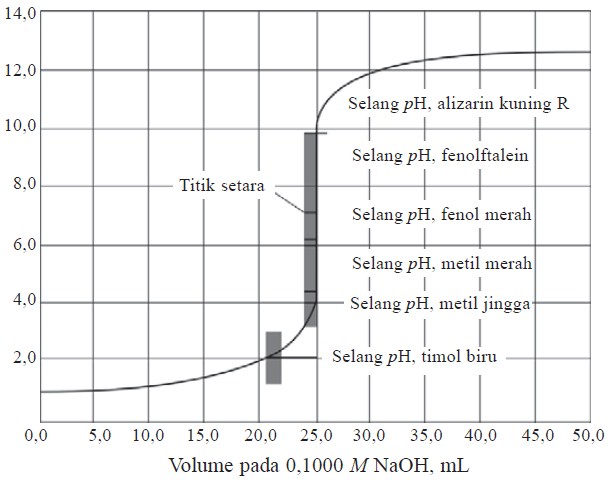
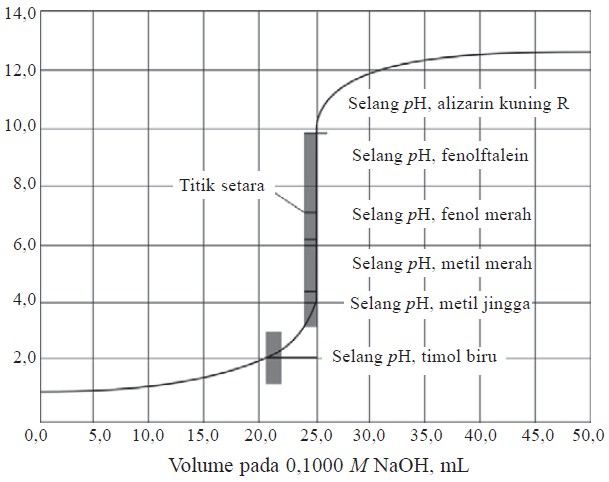
Kurva titrasi asam kuat oleh basa kuat ditunjukkan pada kurva berikut:
Misalnya, 25 mL HCl 0,1 M (asam kuat) dititrasi oleh NaOH 0,1 M (basa kuat), kita dapat menghitung pH larutan pada bermacam-macam titik selama berlangsungnya titrasi. Pada grafik, diperlihatkan ciri penting dari kurva titrasi NaOH – HCl bahwa pH berubah secara lambat sampai dekat titik ekuivalen. Penambahan NaOH menyebabkan harga pH naik sedikit demi sedikit.
Namun, pada titik ekuivalen, pH meningkat sangat tajam kirakira 6 unit (dari pH 4 sampai pH 10) hanya dengan penambahan 0,1 mL (± 2 tetes). Setelah titik ekuivalen, pH berubah amat lambat jika ditambah NaOH. Indikator-indikator yang perubahan warnanya berada dalam bagian terjal kurva titrasi ini, yaitu indikator yang mempunyai trayek pH antara 4 sampai 10 cocok digunakan untuk titrasi tersebut. Indikator yang dapat digunakan pada titrasi ini adalah metil merah, brom timol biru, dan fenolftalein. Untuk titrasi asam kuat oleh basa kuat, besarnya pH saat titik ekuivalen adalah 7.
Baca Juga :
Perhitungan Lengkap Titrasi Penetralan dan Contohnnya
Pada pH ini asam kuat tepat habis bereaksi dengan basa kuat, sehingga larutan yang terbentuk adalah garam air yang bersifat netral.
2. Titrasi Asam Lemah oleh Basa Kuat
Penetralan asam lemah oleh basa kuat agak berbeda dengan penetralan asam kuat oleh basa kuat. Contohnya, 25 mL CH3COOH 0,1 M dititrasi oleh NaOH 0,1 M. Mula-mula sebagian besar asam lemah dalam larutan berbentuk molekul tak mengion CH3COOH, bukan H+ dan CH3COO–.
Dengan basa kuat, proton dialihkan langsung dari molekul CH3COOH yang tak mengion ke OH–. Untuk penetralan CH3COOH oleh NaOH, persamaan ion bersihnya sebagai berikut (James E. Brady, 1990).
CH3COOH(aq) + OH–(aq) ⎯⎯→ H2O(l) + CH3COO–(aq)
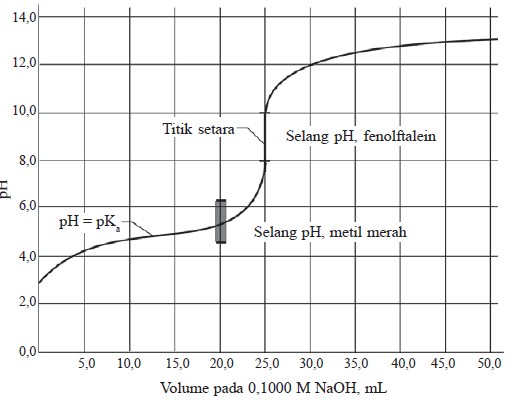
Kurva titrasi asam lemah oleh basa kuat dapat ditunjukkan pada kurva berikut:
Sifat penting yang perlu diingat pada titrasi asam lemah oleh basa kuat adalah:
- pH awal lebih tinggi daripada kurva titrasi asam kuat oleh basa kuat (karena asam lemah hanya mengion sebagian).
- Terdapat peningkatan pH yang agak tajam pada awal titrasi. Ion asetat yang dihasilkan dalam reaksi penetralan bertindak sebagai ion senama dan menekan pengionan asam asetat.
- Sebelum titik ekuivalen tercapai, perubahan pH terjadi secara bertahap. Larutan yang digambarkan dalam bagian kurva ini mengandung CH3COOH dan CH3COO– yang cukup banyak. Larutan ini disebut larutan penyangga.
- pH pada titik di mana asam lemah setengah dinetralkan ialah pH = pKa. Pada setengah penetralan, [CH3COOH] = [CH3COO–].
- pH pada titik ekuivalen lebih besar dari 7, yaitu ± 8,9, sebagai akibat hidrolisis oleh CH3COO–.
- Setelah titik ekuivalen, kurva titrasi asam lemah oleh basa kuat identik dengan kurva asam kuat oleh basa kuat. Pada keadaan ini, pH ditentukan oleh konsentrasi OH– bebas.
- Bagian terjal dari kurva titrasi pada titik ekuivalen dalam selang pH yang sempit (dari sekitar 7 sampai 10).
- Pemilihan indikator yang cocok untuk titrasi asam lemah oleh basa kuat lebih terbatas, yaitu indikator yang mempunyai trayek pH antara 7 sampai 10. Indikator yang dipakai adalah fenolftalein.
3. Titrasi Basa Lemah oleh Asam Kuat
Jika 25 mL NH4OH 0,1 M (basa lemah) dititrasi dengan HCl 0,1 M (asam kuat), maka besarnya pH semakin turun sedikit demi sedikit, kemudian mengalami penurunan drastis pada pH antara 4 sampai 7. Titik ekuivalen terjadi pada pH kurang 7. Oleh sebab itu, indikator yang paling cocok adalah indikator metil merah.
Itulah penjelasan kali ini mengenai titrasi asam basa, semoga dapat memberikan mafaat. Selamat belajar..
Artikel Terkait
- Introductions (Perkenalan)
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?