Jenis Garam dan Reaksi Hidrolisis
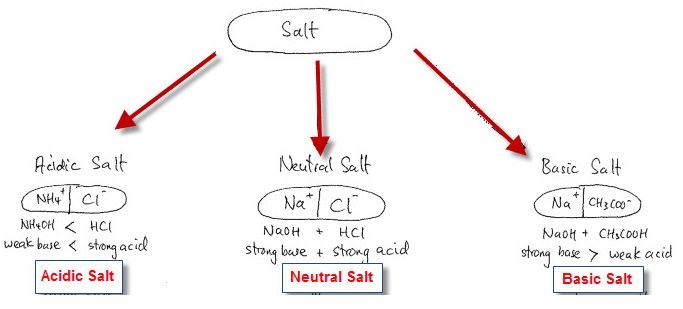
Di dalam air, garam akan terionisasi dan apabila ion garam bereaksi dengan air maka terjadi reaksi hidrolisis. Beberapa kemungkinan reaksi hidrolisis yang dapat terjadi adalah:
-
Garam bereaksi dengan air dan menghasilkan ion H+, menyebabkan konsentrasi ion H+ lebih besar daripada ion OH– sehingga larutan bersifat asam.
-
Ion garam bereaksi dengan air dan menghasilkan ion OH–, menyebabkan ion H+ lebih kecil daripada ion OH– sehingga larutan bersifat basa.
-
Ion garam tidak bereaksi dengan air sehingga konsentrasi ion H+ dan ion OH– di dalam air tidak berubah dan larutan bersifat netral.
Ion garam dianggap bereaksi dengan air jika ion tersebut dalam reaksinya menghasilkan asam lemah atau basa lemah. Apabila garam merupakan hasil reaksi dari suatu asam lemah dengan basa, maka ditinjau dari kekuatan asam dan basa pembentuknya ada empat jenis garam, sebagai berikut:
JENIS GARAM DAN REAKSI HIDROLISIS
1. Garam yang terbentuk dari Asam Lemah dan Basa Kuat
Garam yang berasal dari asam lemah dan basa kuat jika dilarutkan ke dalam air akan menghasilkan anion yang berasal dari asam lemah. Anion tersebut bereaksi dengan air menghasilkan ion OH– yang menyebabkan larutan bersifat basa.
Contoh:
CH3COONa(aq) → CH3COO–(aq) + Na+(aq)
Ion CH3COO– bereaksi dengan air membentuk reaksi kesetimbangan:
CH3COO–(aq) + H2O(l) CH3COOH(aq) + OH–(aq)
Adanya ion OH– yang dihasilkan dari reaksi tersebut mengakibatkan konsentrasi ion H+ di dalam air lebih sedikit daripada konsentrasi ion OH– sehingga larutan bersifat basa. Dari dua ion yang dihasilkan ole garam tersebut, hanya ion CH3COO– yang mengalami hidrolisis, sedangkan ion Na+ tidak bereaksi dengan air. Jika dianggap bereaksi, maka NaOH yang terbentuk akan segera terionisasi menghasilkan ion Na+ kembali. Hidrolisis ini disebut hidrolisis sebagian (hidrolisis parsial) sebab hanya sebagian ion (ion CH3COO–) yang mengalami reaksi hidrolisis.
Jadi, garam yang berasal dari asam lemah dan basa kuat akan terhidrolisis sebagian (parsial) dan bersifat basa.
2. Garam yang Terbentuk dari Asam Kuat dan Basa Lemah
Garam yang berasal dari asam kuat dan basa lemah jika dilarutkan ke dalam air akan menghasilkan kation yang berasal basa lemah. Kation tersebut bereaksi dengan air dan menghasilkan ion H+ yang menyebabkan larutan bersifat asam.
Baca Juga :
Sifat Larutan Asam, Basa, dan Garam
Contoh:
NH4Cl(aq) → NH4+(aq) + Cl–(aq)
Ion NH4+ bereaksi dengan air membentuk reaksi kesetimbangan:
NH4+(aq) + H2O(l) NH4OH(aq) + H+(aq)
Adanya ion H+ yang dihasilkan dari reaksi tersebut mengakibatkan konsentrasi ion H+ di dalam air lebih banyak daripada konsentrasi ion OH– sehingga larutan bersifat asam. Dari kedua ion yang dihasilkan oleh garam tersebut, hanya ion NH4+ yang mengalami hidrolisis, sedangkan ion Cl– tidak bereaksi dengan air. Jika dianggap bereaksi, maka HCl yang terbentuk akan segera terionisasi menghasilkan ion Cl– kembali. Hidrolisis ini juga disebut hidrolisis sebagian (hidrolisis parsial) sebab hanya sebagian ion yang mengalami reaksi hidrolisis.
Jadi, garam yang berasal dari asam kuat dan basa lemah akan terhidrolisis sebagian (parsial) dan bersifat asam.
3. Garam yang terbentuk dari Asam Lemah dan Basa Lemah
Garam yang berasal dari asam lemah dan basa lemah di dalam air akan terionisasi, adn kedua ion garam tersebut bereaksi dengan air.
Contoh:
NH4CN(aq) → NH4+(aq) + CN–(aq)
Ion NH4+ bereaksi dengan air membentuk reaksi kesetimbangan:
NH4+(aq) + H2O(l) NH4OH(aq) + H+(aq)
Ion CN– bereaksi dengan air membentuk reaksi kesetimbangan:
CN–(aq) + H2O(l) HCN(aq) + OH–(aq)
Oleh karena dari kedua ion garam tersebut masing-masing menghasilkan ion H+ dan ion OH–, maka sifat larutan garam ini ditentukan oleh nilai tetapan kesetimbangan dari kedua reaksi tersebut. Hidrolisis yang berasal dari asam lemah dan basa lemah merupakan hidrolisis total, sebab kedua ion garam mengalami reaksi hidrolisis dengan air.
Sifat larutan ditentukan oleh nilai tetapan kesetimbangan dari kedua reaksi tersebut. Jika Ka > Kb, maka larutan bersifat asam, dan jika Ka < Kb, maka larutan akan bersifat basa.
4. Garam yang Terbentuk dari Asam Kuat dan Basa Kuat
Ion – ion yang dihasilkan dari ionisasi garam yang berasal dari asam kuat dan basa kuat tidak ada yang bereaksi dengan air, sebab jika dianggap bereaksi maka akan segera terionisasi kembali serta secara sempurna membentuk ion – ion semula.
Contoh:
NaCl(aq) → Na+(aq) + Cl–(aq)
Ion Na+ dan ion Cl– di dalam larutan tidak mengalami reaksi dengan air, sebab jika dianggap bereaksi dengan air, maka ion Na+ akan menghasilkan NaOH yang akan segera terionisasi kembali menjadi ion Na+. Hal ini disebabkan NaOH merupakan basa kuat yang terionisasi sempurna. Demikian pula jika ion Cl– dianggap bereaksi dengan air, maka HCl yang terbentuk akan segera terionisasi sempurna menjadi ion Cl– kembali. Hal ini disebabkan HCl merupakan asam kuat yang akan terionisasi sempurna.
Kesimpulannya, garam yang berasal dari asam kuat dan basa kuat tidak terhidrolisis. Oleh karena itu, konsetrasi ion H+ dan OH– dalam air tidak terganggu, sehingga larutan bersifat netral.
Artikel Terkait
- Introductions (Perkenalan)
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?