Rumus Tetapan Kesetimbangan Air (Kw)
.jpg)
Air murni hampir tidak menghantarkan arus listrik. Hanya alat pengukuran yang sangat peka yang dapat menunjukkan bahwa air murni memiliki daya hantar listrik yang sangat kecil. Hal itu berarti hanya sebagian kecil molekul-molekul air dapat terionisasi menjadi ion H+ dan ion OH-.
Baca juga: Kesetimbangan Kimia ( Pembahasan Soal tetapan kesetimbangangan Kc )
Persamaan ionisasi air dapat ditulis sebagai:
H2O(l) ⇄ H+(aq) + OH-(aq)
Harga tetapan air adalah:
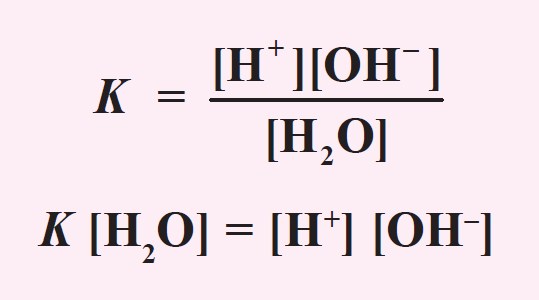
Konsentrasi H2O yang terionisasi menjadi H+ dan OH- sangat kecil dibandingkan dengan konsentrasi H2O mula-mula, sehingga konsentrasi H2O dapat dianggap tetap, maka harga K[H2O] juga tetap, yang disebut tetapan kesetimbangan air atau ditulis Kw. Jadi,
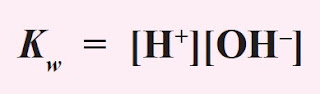
Pada suhu 25 °C, Kw yang didapat dari percobaan adalah 1,0 × 10-14. Harga Kw ini tergantung pada suhu, tetapi untuk percobaan yang suhunya tidak terlalu menyimpang jauh dari 25 °C, harga Kw itu dapat dianggap tetap.
Harga Kw pada berbagai suhu dapat dilihat pada tabel berikut:
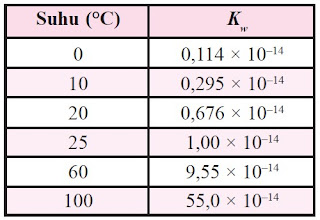
Oleh karena [H+][OH-] = 10-14, maka [H+]= 10-7 dan [OH-] = 10-7. Artinya, dalam 1 liter air murni terkandung ion H+ dan ion OH- masing-masing sebanyak 10-7 mol.
Jika ke dalam air ditambahkan suatu asam, maka [H+] akan bertambah tetapi hasil perkalian [H+][OH-] tetap sama dengan Kw. Hal ini dapat terjadi karena kesetimbangan bergeser ke kiri yang menyebabkan pengurangan [OH-]. Kesetimbangan juga akan bergeser jika ke dalam air ditambahkan suatu basa. Dari pembahasan ini dapat disimpulkan sebagai berikut.
Catatan:
-
Dalam larutan berair = [H+][OH-] = Kw
-
Dalam air murni (larutan netral) = [H+] = [OH-]
-
Dalam larutan asam = [H+] > [OH-]
-
Dalam larutan basa = [H+] < [OH-]
Artikel Terkait
- Suatu batang AB memiliki panjang 0,9 meter dan massanya diabaikan. Di titik A digantung beban 35 kg dan di titik B sebesar 40 kg. Agar batang setimbang, maka harus diletakkan penumpu pada jarak dari B
- Dari gambar berikut, urutan untuk benda- benda yang berada dalam keseimbangan stabil, indifferent, labil
- Pergeseran Kesetimbangan dan Faktor-faktor yang Mempengaruhinya
- Titik Berat dan Keseimbangan Benda Tegar
- Kesetimbangan Kimia ( Pembahasan Soal tetapan kesetimbangangan Kc )
- Faktor - faktor yang Mempengaruhi Kesetimbangan Kimia
- Memahami Kesetimbangan Benda Tegar Melalui Pembahasan Soal
- Kesetimbangan Kimia
- Kesetimbangan Kimia ( Pembahasan Soal tetapan kesetimbangangan Kc )
- Titrasi Asam Basa