REAKSI BOLAK – BALIK
Reaksi bolak – balik (reversible) adalah reaksi yang produknya dapat berubah lagi menjadi zat semula. Biasanya ditulis dengan dua panah yang berlawanan arah. Berikut penjelasannya.
REAKSI BOLAK – BALIK
Untuk memahami reaksi bolak balik, coba perhatikan reaksi antara larutan natrium iodida yang tidak berwarna bereaksi dengan Timbal (II) sulfat yang berupa padatan berwarna putih menghasilkan endapan timbal (II) iodida yang berwarna kuning dan larutan natrium sulfat dengan reaksi sebagai berikut:
PbSO4(s) + 2NaI(aq) → PbI2(s) + Na2SO4(aq)
(putih) (kuning)
Sebaliknya, jika padatan timbal (II) iodida yang berwarna kuning dari hasil reaksi di atas direaksikan dengan larutan natrium sulfat, maka akan terbentuk kembali endapan warna putih timbal (II) sulfat dengan reaksi:
PbI2(s) + Na2SO4(aq) → PbSO4(s) + 2NaI(aq)
(kuning) (putih)
Dengan memperhatikan kedua reaksi di atas, terlihat bahwa reaksii yang kedua merupakan kebalikan dari reaksi yang pertama, maka disebut reaksi dapat balik. Jika kedua reaksi tersebut berlangsung secara bersamaan (serentak), maka disebut reaksi bolak – balik dan ditulis dengan dua panah yang berlawanan arah (). Jadi, reaksi bolak – balik (reversible) adalah reaksi di mana produknya dapat berubah lagi menjadi zat semula.
PbSO4(s) + 2NaI(aq) PbI2(s) + Na2SO4 (aq)
Selain reaksi yang dapat balik, reaksi kimia juga ada yang tidak dapat balik arau reaksi berkesudahan, yaitu reaksi kimia dimana zat – zat hasil reaksi tidak dapat saling bereaksi kembali menjadi zat pereaksi.
Contoh
NaOH(aq) + HCl(aq) PbI2(s) + Na2SO4(aq)
Reaksi antara natrium hidroksida (NaOH) dan asam klorida (HCl) hanya dapat berlangsung ke arah kanan. Hal ini dapat ditunjukan dengan cara mereaksikan kembali ke hasil reaksi, yaitu NaCl dan H2O. Fakta menunjukan bahwa NaCl tidak akan bereaksi dengan air membentuk NaOH dan HCl.
Seperti halnya pada kesetimbangan penguapan dan pengembunan air di dalam botol tertutup, dalam reaksi kimia akan terjadi kesetimbangan bila reaksinya merupakan reaksibolak – balik dan berlangsung dalam sistem tertutup. Arti tertutup adalah tidak ada zat, baik pereaksi maupun hasil reaksi yang meninggalkan sistem.
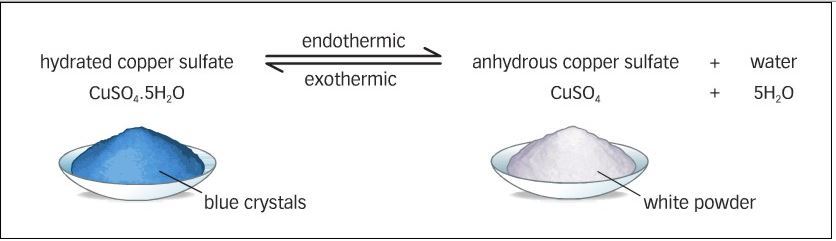
Contoh reaksi bolak balik lainnya adalah pemanasan CuSO4.5H2O, dimana 5H2O nya akan dilepas, tetapi ketika didinginkan CuSO4 menyerap kembali H2O yang telah dilepas.

Contoh reaksi bolak – balik
Demikian ulasan mengenai reaksi bolak – balik. Semoga bermanfaat…..
Artikel Terkait
- Zat Tunggal yang Tidak Bisa Lagi Disederhanakan Menggunakan Reaksi Kimia Biasa Disebut Dengan...
- Berikut Ini yang Bukan Merupakan Sifat Fisika Suatu Zat Adalah?
- Zat tunggal yang tidak dapat diuraikan menjadi zat lain dengan reaksi kimia biasa disebut
- Pengertian Tumbuhan Lengkap dengan Ciri-cirinya
- Sifat-sifat Enzim dan Penjelasan lengkap
- Transformasi Energi Dalam Sel
- Faktor-Faktor Yang Mempengaruhi Laju Reaksi
- Rumus Tetapan Kesetimbangan Air (Kw)
- Bagaimana Cara Penentuan Perubahan Entalpi (Termokimia) ?
- Logam Alkali Tanah: Sifat-sifat dan Kegunaannya