Entropi Dalam Termodinamika
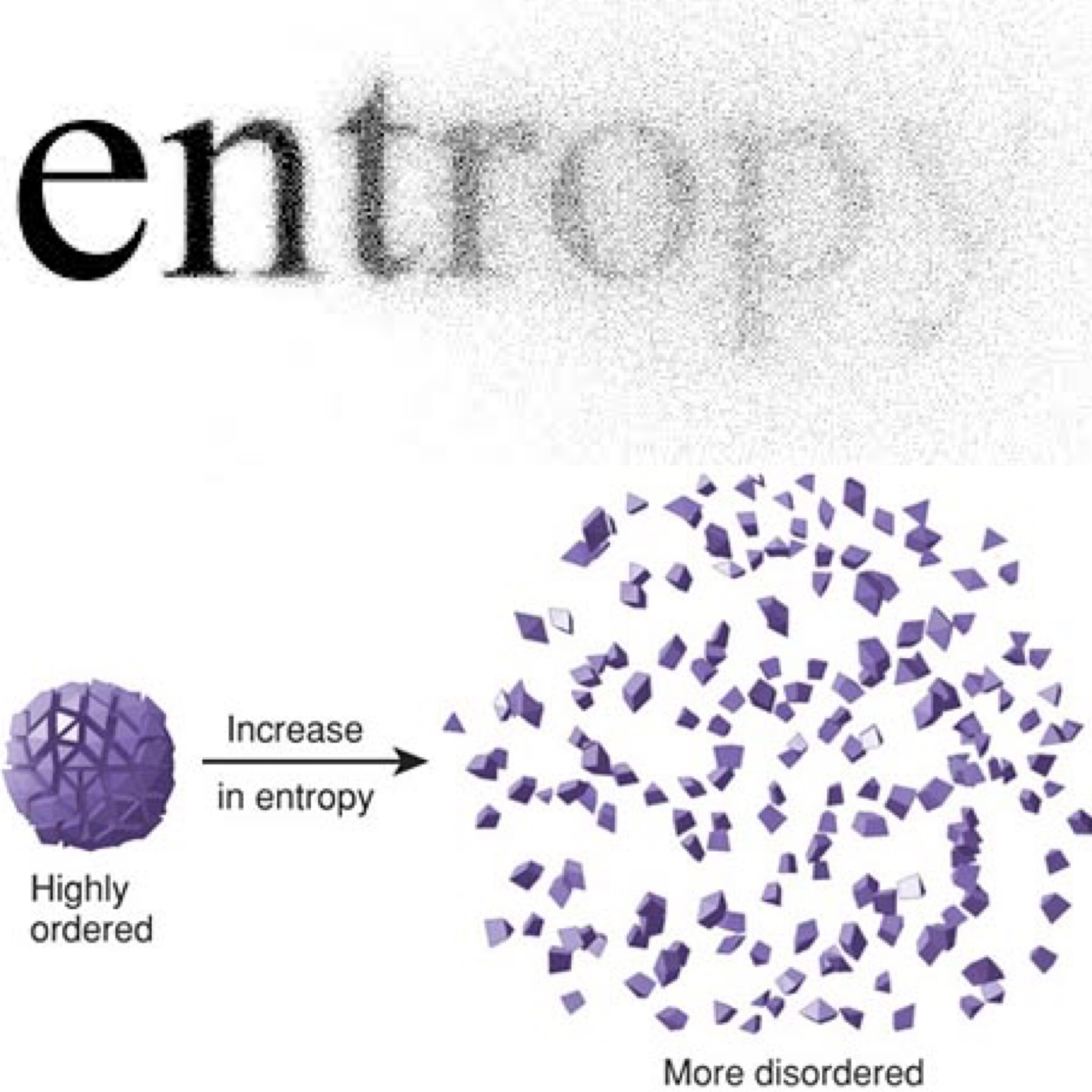
Entropi adalah sifat termodinamika yang penting dari sebuah zat, dimana harganya akan meningkat ketika ada penambahan kalor dan menurun ketika terjadi pengurangan kalor. Adalah sulit untuk mengukur entropi, tetapi akan mudah untuk mencari perubahan entropi dari suatu zat. Pada jangkauan kecil temperature, kenaikan atau penurunan entropi jika dikalikan dengan temperature akan menghasilkan jumlah kalor yang diserap atau dilepaskan oleh suatu zat.
Secara matematis:
dQ = T.ds
dimana: dQ = Kalor yang diserap
T = temperatur absolut
ds = kenaikan entropi.
Persamaan di atas juga bisa digunakan untuk kalor yang dilepaskan oleh suatu zat, dalam hal ini ds menjadi penurunan entropi.
Para ahli teknik dan ilmuwan menggunakan entropi untuk memberikan jawaban cepat terhadap permasalahan yang berkaitan dengan ekspansi adiabatik.
Entropi adalah ukuran banyaknya energi atau kalor yang tidak dapat diubah menjadi usaha. Besarnya entropi suatu sistem yang mengalami proses reversibel sama dengan kalor yang diserap sistem dan lingkungannya dibagi suhu mutlak sistem tersebut (T). Entropi adalah fungsi keadaan, nilainya pada suatu keadaan setimbang dapat dinyatakan dalam variabel-variabel yang menentukan keadaan sistem. Asas kenaikan entropi dapat dinyatakan bahwa entropi selalu naik pada tiap proses ireversibel. Karena itu dapat dikatakan bahwa entropi dari suatu sistem terisolasi sempurna selalu naik tiap proses ireversibel.
Dalam proses adiabatik, d’Q = 0, dan dalam proses adaibatik ireversibel d’Qr = 0. Oleh karena itu dalam proses adibatik reversibel, ds = 0 atau ini berarti bahwa entropi S tetap. Proses demikian ini disebut pula sebagai proses insentropik. Jadi:
d’Qr = 0 dan dS = 0
Dalam proses isotermal reversibel, suhu T tetap, sehingga perubahan entropi
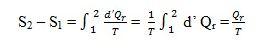
Untuk melaksanakan proses semacam ini maka sistem dihubungkan dengan sebuah reservoir yang suhunya berbeda. Jika arus panas mengalir masuk kedalam sistem, maka Qr positif dan entropi sistem naik. Jika arus panas keluar dari sistem Qr negatif dan entropi sistem turun.
Contoh proses isotermal reversibel ialah perubahan fase pada tekanan tetap. Arus panas yang masuk kedalam sistem per satuan massa atau per mol sama dengan panas transformasi 1, sehingga perubahan entropi jenisnya menjadi :
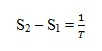
Jika dalam suatu proses terdapat arus panas antara sistem dengan lingkungannya secara reversibel, maka pada hakekatnya suhu sistem dan suhu lingkungan adalah sama. Besar arus panas ini yang masuk kedalam sistem atau yang masuk kedalam lingkungan disetiap titik adalah sama, tetapi harus diberi tanda yang berlawanan. Karena itu perubahan entropi lingkungan sama besar tapi berlawanan tanda dengan perubahan entropi sistem dan jumlahnya menjadi nol. Sebab sistem bersama dengan lingkungannya membentuk dunia, maka boleh dikatakn bahwa entropi dunia adalah tetap. Hendaknya diingat bahwa pernyataan ini berlaku untuk proses reversibel saja.
Keadaan akhir proses irreversibel itu dapat dicapai dengan ekspansi reversibel. Dalam ekspansi semacam ini usaha luar haus dilakukan. Karena tenaga dakhil sistem tetap, maka harus ada arus panas yang mengalir kedalam sistem yang sama besarnya dengan usaha luar tersebut. Entropi dalam gas dal proses reversibel ini naik dan kenaikan ini sama dengan kenaikan dalam proses sebenarnya yang irreversibel, yaitu ekspansi bebas.
Bagaimanakah Asas Kenaikkan Entropi?
Hukum keseimbangan / kenaikan entropi menyatakan bahwa “Panas tidak bisa mengalir dari material yang dingin ke yang lebih panas secara spontan”. Entropi adalah tingkat keacakan energi. Jika satu ujung material panas, dan ujung satunya dingin, dikatakan tidak acak, karena ada konsentrasi energi. Dikatakan entropinya rendah. Setelah rata menjadi hangat, dikatakan entropinya naik.
Dalam pembahasan proses-proses ireversibel dalam pasal terdahulu, didapatkan bahwa entropi dunia (unuiverse) selalu naik. Hal ini juga benar untuk semua proses ireversibel yang sudah dapat dianalisa. Kesimpulan ini dikenal sebagai asas kenaikan entropi dan dianggap sebagai bagian dari hukum kedua termodinamika. Asas ini dapat dirumuskan sebagai berikut.
“Entropi dunia selalu naik pada setiap proses ireversibel”
Jika semua sistem yang berinteraksi di dalam suatu proses di lingkungi dengan bidang adiabatik yang tegar, maka semua itu membentuk sistem yang terisolasi sempurna dan membentuk dunianya sendiri. Karena itu dapat dikatakan bahwa entropi dari suatu sistem yang terisolasi sempurna selalu naik dalam proes ireversibel yang terjdai dalam sistem itu. Sementara itu entropi tetap tidak berubah dalam sistem yang terisolasi jika sistem itu mengalami proses reversibel.
Baca Juga :
Bagaimana Cara Kerja Mesin Bensin 4 Tak
Entropi Dalam mesin Carnot
Dalam mesin Carnot, dapat dilihat bahwa besaran dQ=T adalah besaran keadaan, karena perubahannya untuk satu siklus adalah nol
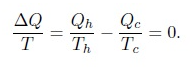
(tanda negatif karena Qc adalah panas yang keluar sistem), nilai di atas nol karena Qc=Qh = Tc=Th. Sehingga besaran dQ=T adalah besaran keadaan, tetapi pada proses Carnot, semua proses adalah proses reversible, karena itu dide_nisikan suatu besaran keadaan yang disebut entropi S,
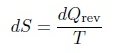
dengan dQrev adalah panas yang ditranfer dalam proses reversibel.
Untuk proses irreversible, perubahan entropinya dapat dicari dengan mencari suatu proses reversible yang memiliki keadaan awal dan akhir yang sama dengan proses irreversible yang ditinjau (ini karena perubahan entropi adalah besaran keadaan). Pada proses reversible, perubahan entropi total, yaitu perubahan entropi sistem dan lingkungannnya adalah nol, karena untuk setiap bagian prosesnya besar panas yang diberikan sistem ke lingkungan sama dengan besar panas yang diberikan lingkungan pada sistem, dan selama proses sistem dan lingkungan memiliki suhu yang sama (ingat de_nisi proses reversible). Sehingga total perubahan entropi

Untuk proses yang irreversible, karena prosesnya tidak berada dalam keadaan kesetimbangan termal, maka total perubahan entropi selalu positif. Tinjau suatu perpindahan panas dari benda yang panas pada suhu Th ke lingkungannya yang dingin pada suhu Tc (dengan Th > Tc). Panas yang diberikan benda ΔQ sama
Satuan Entropi
Satuan entropi bergantung pada satuan kalor yang digunakan dan temperatur mutlak. Entropi dinyatakan per satuan massa zat. Kita tahu bahwa:
Perubahan entropi = Kalor yang diberikan atau dilepaskan / Temperatur mutlak
Sehingga jika satuan kalor adalah kcal dan temperatur dalam 0K, maka satuan entropi adalah kcal/kg/0K. Karena entropi dinyatakan per satuan massa zat, maka adalah benar jika entropi disebut sebagai entropi spesifik.
Secara teoritis, entropi suatu zat adalah nol pada temperatur nol absolut. Sehingga di dalam perhitungan entropi, referensi dasar yang mudah harus dipilih sehingga dari referensi ini pengukuran dilakukan. Perlu dicatat bahwa air pada 00 C diasumsikan mempunyai entropi nol, dan perubahan entropi dihitung dari temperatur ini.
Artikel Terkait
- Sejumlah gas ideal dipanaskan hingga suhunya 2 kali semula pada tekanan tetap dengan mengambil kalor dari sumber panas sebesar 300 j untuk melakukan kerja sebesar 250 j. selama siklus terjadi besarnya energi dalam yang dikerjakan oleh gas sebesar
- Suatu mesin Carnot, jika reservoir panasnya bersuhu 400 K akan mempunyai efisiensi 40%. Jika reservoir panasnya bersuhu 640 K, efisiensinya menjadi …. %.
- Mesin Carnot bekerja pada suhu tinggi 600 K mempunyai efisiensi 40%. Agar efisiensi mesin naik menjadi 75% dengan suhu reservoir rendah tetap, maka reservoir suhu tinggi harus dinaikkan menjadi ... ?
- Contoh Soal Termodinamika (Fisika SMA) - Go Royong With Agiv
- Hukum 3 Termodinamika (Fisika SMA) - Go Royong With Agiv
- Pengertian Termodinamika
- Contoh Soal dan Pembahasan Teori Kinetik Gas
- Teori Kinetik Gas dan Sifatnya
- Ringkasan Materi Suhu dan Kalor
- Ringkasan Materi Suhu dan Kalor