Elektrolisis Beserta Soal dan Pembahasannya
Elektrolisis memanfaatkan energi listrik untuk menjalankan reaksi redoks yang tidak spontan. Disini akan dibahas mengenai pengertian elektrolisis, Simak selengkapnya di bawah ini
ELEKTROLISIS
A. Pengertian elektrolisis
Berlawanan dengan pembahasan sebelumnya elektrokimia/ sel volta, yang memanfaatkan reaksi redoks spontan untuk menghasilkan energi listrik, sekarang kita akan membahas elektrolisis, yang memanfaatkan energi listrik untuk menjalankan reaksi redoks yang tidak spontan. Sel elektrolisis merupakan perangkat yang digunakan dalam proses elektrolisis, yang terdiri atas sumber arus searah serta elektrode positif dan negatif. Zat yang dielektrolisis merupakan elektrolit berupa larutan atau cairan (lelehan) zat murni.ika suatu cairan atau larutan elektrolit dialiri arus listrik searah melalui batang elektrode, ion-ion yang berada dalam cairan atau larutan tersebut akan bergerak menuju elekrode yang muatannya berlawanan. Jadi,
Sel Elektrolisis adalah sel yang menggunakan energi listrik untuk menghasilkan reaksi kimia yang tidak spontan.
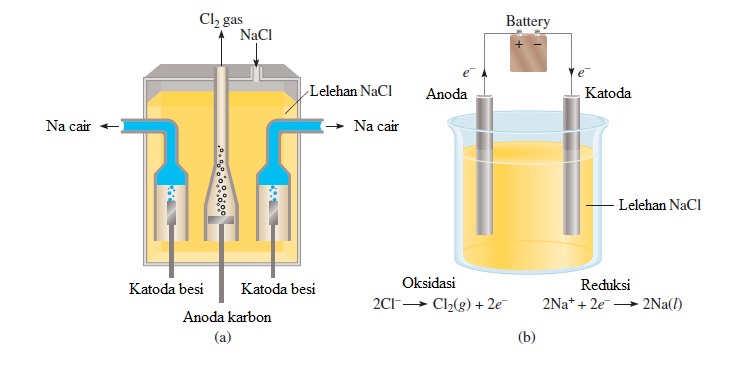
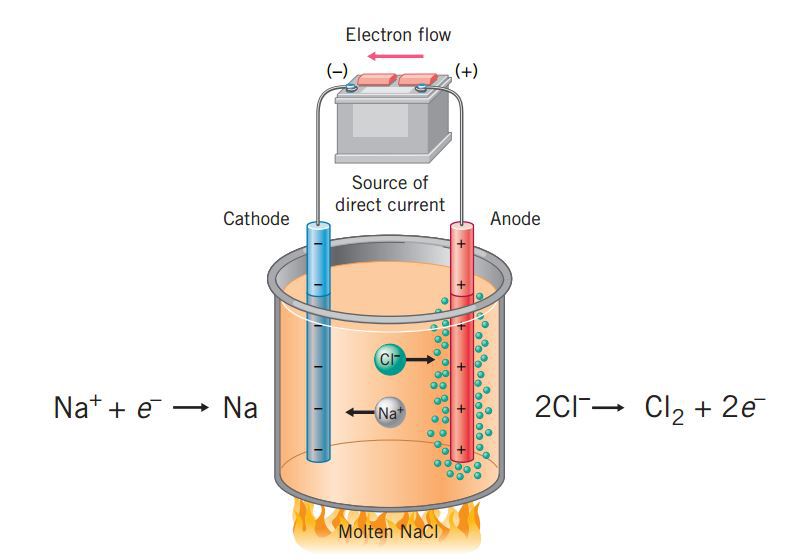
Elektrolisis pada lelehan NaCl
Gambar di atas menunjukan lelehan NaCl yang dielektrolisis dengan elektrode karbon (grafit). Di dalam larutan terdapat beberapa spesi, antara lain ion Na+ dan ion Cl– dari ionisasi NaCl. Akibat pengaruh arus listrik searah yang dialirkan melalui batang elektrode, ion-ion Na+ bergerak ke kutub negatif dan ion-ion Cl–bergerak ke kutub positif. Kemudian, ion Cl– akan melepaskan elektronnya atau mengalami oksidasi.
2Cl–(l) → Cl2(g) + 2e– ……… (oksidasi)
Selanjutnya, elektron yang dilepas oleh Cl– tersebut akan mengalir melalui penghantar menuju ke elektrode negatif, yang disekitarnya terdapat ion Na+. Elektron tersebut ditangkap oleh ion Na+, sehingga terjadi reduksi.
2Na+(l) + 2e– → 2Na(l) ……. (reduksi)
Jadi, pada elektrolisis larutan NaCl terjadi reaksi:
Elektrode positif : 2Cl–(l) → Cl2(g) + 2e–
Elektrode negatif : Na+(l) + e– → Na(l)
Reaksi elektrolisis : 2Cl–(l) + 2Na+(l) → Cl2(g) + 2Na(l)
Berdasarkan contoh di atas, dapat disimpulkan bahwa pada elektrolisis:
- Kutub positif merupakan anode dan kutub positif terjadi reaksi oksidasi.
- Kutub Negatif merupakan katode dan kutub negatif terjadi reaksi reduksi.
Jadi,pada elektrolisis lelehan NaCl tersebut, di anode dihasilkan gas Cl2 serta di katode dihasilkan lelehan Na.
Sebenarnya telah disinggung sebelumnya pada sel volta, sama seperti sel volta dimana anode selalu mengalami oksidasi, sedangkan katode selalu mengalami reduksi. Untuk mempermudah bisa pakai singkatan, Katode (K) mengalami Reduksi (R), disini sama-sama konsonan. Sedangkan Anode (A) mengalami Oksidasi (O), disini sama-sama huruf vokal.
KRAO
Katode Reduksi Anode Oksidasi
Nah,perbedaan dengan sel Volta adalah tanda elektrodenya. Kalau di elektrolisis Katode muatannya negatif dan Anode muatannya positif.
KNAP
Katode Negatif Anode Positif
B. Reaksi-reaksi yang terjadi pada sel elektrolisis ditentukan oleh:
1. Ion-ion di sekitar elektrode
Pada anode, ion-ion di sekitar anode yang memiliki Eolebih negatif yang akan mengalami oksidasi. Pada katode, ion-ion di sekitar katode yaang memiliki Eo lebih positif yang akan mengalami reduksi.
Contoh:
Pada elektrolisis larutan KI digunakan elektrode grafit. Spesi yang ada di dalamnya adalah ion K+ dan I– dari hasil ionisaisi KI dan juga ada H2O sebagai pelarut (karena larutan). Oleh karena elektrodenya grafit yang inert, elektrodenya tidak mengalami reaksi apapun. Di sekitar anode terdapat H2O(l) dan ion I– yang akan teroksidasi.
2H2O(l) → 4H+(aq) + O2(g) + 4e– Eo= +1,23 V
2I–(aq) → I2(g) + 2e– Eo= -0,54 V
Di sekitar katode terdapat ion K+ dan H2O sehingga lebih mudah mengalami reduksi adalah atom H pada H2O.
2H2O(l) + 2e— → H2(g) + 2OH–(aq) Eo = -0,83 V
K+(aq) + e– → K(s) Eo= -2,93 V
Jadi,pada elektrolisis larutan KI dengan elektrode grafit, reaksi yang terjadi adalah:
2KI(aq) → 2K+(aq) + 2I–(aq)
Anode (+) : 2I–(aq) → Cl2(g) + 2e–
Katode (-) : 2H2O(l) + 2e– → H2(g) + 2OH–(aq)
———————————————————————————– +
Reaksi total : 2KI(aq) + 2H2O(l) → I2(g) + 2K+(aq) + 2OH–(aq)
Hasil elektrolisis larutan KI adalah gas I2 di anode serta larutan KOH dan gas H2 di katode.
Jika di sekitar elektrode tidak reaktif (inert) hanya terdapat jenis zat atau ion, maka zat atau ion tersebut yang mengalami oksidasi atau reduksi.
Contoh:
Elektrolisis lelehan KI dengan elektrode grafit.
2KI(l) → 2K+(l) + 2I–(l)
Anode (+) : 2I–(l) → I2(g) + 2e–
Katode (-) : 2K+(l) + 2e– → 2K(l)
———————————————– +
Reaksi total: 2KI(l) → 2K(l) + I2(g)
Hasil elektrolsis lelehan KI dengan elektrode grafit adalah gas I2 di anode dan logam kalium cair di katode.
Baca Juga :
Cara Penyetaraan Reaksi Redoks dengan Cara Setengah Reaksi atau Ion Elektron
Cara Penyetaraan Reaksi Redoks dengan Cara Bilangan Oksidasi (Biloks)
2. Bahan elektrode
- Jika bahan elektrode terbuat dari grafit (C) atau logam inert (misalnya Pt atau Au),elektrode tidak mengalami oksidasi atau reduksi. Jadi yang mengalami oksidasi dan reduksi adalah spesi-spesi yang ada di sekitar elektrode.
- Jika elektrode (terutama anode) berasal darilogam aktif, anode tersebut yang akan mengalami oksidasi.
Contoh:
Kita bandingkan hasil elektrolisis larutan Na2SO4 dengan elektrode inert (misalnya grafit, C) dan dengan elektroda reaktif (misalnya Cu).
1. Reaksi elektrolisis larutan Na2SO4 encer dengan elektrode grafit
Na2SO4(aq) → 2Na+(aq) + SO42-(aq)
Anode (+) : 2H2O(l) → 4H+(aq) + O2(g) + 4e–
Katode (-) : 4H2O(l) + 4e– → 2H2(g) + 4OH–(aq)
———————————————————————— +
Reaksi total: 2H2O(l) → 2H2(g) + O2(g)
Hasil elektrolisisnya adalah gas oksigen di anode dan gas hidrogen di katode.
2. Reaksi elektrolisis larutan Na2SO4 dengan elektrode tembaga.
Na2SO4(aq) → 2Na+(aq) + SO42-(aq)
Anode (+) : 2Cu(s) → Cu2+(aq) + 4e–
Katode (-) : 4H2O(l) + 4e–→ 2H2(g) + 4OH–(aq)
Oleh karena anodenya dari Cu (anode reaktif), maka anode tersebut mengalami oksidasi dan hasilnya adalah ion Cu2+ di anode dan gas hidrogen di katode.
OK itu konsep intinya, jika ingin lebih ringkas bisa gunakan bagan berikut ini untuk memprediksi reaksi yang akan terjadi pada sel elektrolisis.
OK deh kita coba pada contoh soal elektrolisis :
Contoh soal Elektrolisis
Tuliskan reaksi elektrolisis berikut!
- Lelehan NaCl dengan elektrode Pt
- Larutan BaSO4 dengan elektrode C
- Larutan CuCl2 dengan elektrode Au
Penyelesaian;
1. NaCl(l) → Na+(l) + Cl–(l)
Katode (-) : Na+(l) + e–→ Na(l) x2
Anode (+) ; 2Cl–(l) → Cl2(g) + 2e– x1
——————————————————- +
2Na+(l) + 2Cl–(l) → 2Na(l) + Cl2(g)
2NaCl(l) → 2Na(l) + Cl2(g)
2. BaSO4(aq) → Ba2+(aq) + SO42-(aq), jangan lupa ada air sebagai pelarutnya
Katode (-) : 2H2O(l) + 2e– → 2OH–(aq) + H2(g) x2
Anode (+): 2H2O(l) → O2(g) + 4H+(aq) + 4e– x1
——————————————————————— +
4H2O(l) + 2H2O(l) → 4OH–(aq) + 2H2(g) + O2(g) + 4H+(aq)
2H2O(l) → 2H2(g) + O2(g)
3. CuCl2(aq) → Cu2+(aq) + 2Cl–(aq)
Katode (-) : Cu2+(aq) + 2e– → Cu(s)
Anode (+): 2Cl–(aq) → Cl2(g) + 2e–
———————————————————– +
Cu2+(aq) + 2Cl–(aq) → Cu(s) + Cl2(g)
CuCl2(aq) → Cu(s) + Cl2(g)
Demikian pembahasan mengenai elektrolisis. Jika ada masukan, saran, ataupun pertanyaan silahkan berkomentar ya. Semoga bermanfaat….
Artikel Terkait
- Introductions (Perkenalan)
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?