Aturan serta Pengecualian dan Kegagalan Oktet
Adapun defenisi dari aturan oktet atau kaidah oktet adalah suatu aturan sederhana dalam kimia yang menyatakan bahwa atom-atom cenderung bergabung bersama dengan atom lainnya dimana tiap-tiap atom memiliki delapan elektron dalam kelopak valensinya, membuat konfigurasi elektron atom tersebut sama dengan konfigurasi elektron pada gas mulia.
Aturan Oktet
Aturan oktet ini dapat diterapkan pada unsur-unsur golongan utama, utamanya karbon, nitrogen, oksigen, dan halogen. Aturan ini juga dapat diterapkan pada unsur logam seperti natrium dan magnesium. Secara sederhana, molekul ataupun ion cenderung menjadi stabil apabila kelopak elektron terluarnya mengandung delapan elektron. Aturan ini pertama kali dikemukakan oleh Gilbert Newton Lewis dan W. Kossel.
Kecenderungan unsur-unsur lain mencapai konfigurasi stabil gas mulia (elektron valensi 8) disebut dengan hukum oktet, sedangkan kecenderungan mencapai konfigurasi stabil gas mulia (elektron valensi 2) disebut hukum duplet. Suatu atom dapat mencapai kestabilan konfigurasi elektron atom gas mulia dengan cara melepaskan elektron, menerima/menangkap elektron, dan menggunakan pasangan elektron secara bersama-sama. Berikut penjelasannya:
1. Pelepasan Elektron
Atom-atom yang memiliki kelebihan konfigurasi elektron (1, 2, atau 3 elektron) dibandingkan dengan konfigurasi elektron gas mulia yang terdekat maka cenderung untuk melepaskan elektronnya.
2. Penerimaan Elektron
Penerimaan elektron dapat terjadi pada atom yang memiliki kekurangan konfigurasi (1, 2, atau 3 elektron) dibandingkan dengan konfigurasi elektron gas mulia yang terdekat.
3. Penggunaan Elektron Bersama
Penggunaan elektron secara bersama-sama dapat terjadi pada atom yang mempunyai keelektronegatifan tinggi atau atom yang sukar melepakan elektronnya. Cara ini merupakan proses yang terjadi pada pembentukan ikatan kovalen. Ikatan ini dapat terjadi pada unsur-unsur sesama nonlogam karena unsur-unsur yang sama cenderung untuk menarik elektron. Konfigurasi elektron yang lebih stabil dicapai dengan cara memasangkan elektron valensinya. Jumlah elektron yang dipasangkan sesuai dengan keadaan paling stabil yang mungkin dicapai.
Baca Juga :
Konfigurasi Elektron Berdasarkan Kaidah Oktet dan Duplet
Pengertian Ikatan Kimia Dan Cara Unsur Mencapai Kestabilan
Cara Menghitung Massa Atom Relatif (Ar) dan Massa Molekul Relatif (Mr)
4. Menerima Pasangan Elektron
Elektron-elektron dilepas, ditambah, atau dipasangkan dalam mencapai konfigurasi elektron yang paling stabil. Berbagai unsur mencapai konfigurasi elektron yang lebih stabil dengan menerima pasangan elektron dari atom unsur lain. Kemudian, pasangan elektron tersebut menjadi milik bersama membentuk ikatan kovalen koordinasi.
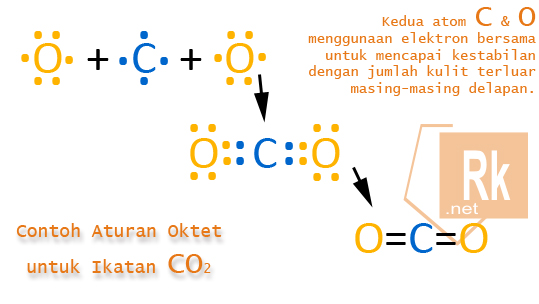
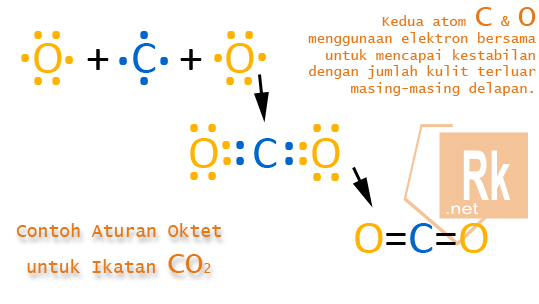
Contoh Ikatan yang Sesuai Aturan Oktet
Ikatan pada karbon dioksida (CO2) dimana semua atom dikelilingi oleh 8 elektron. Oleh karena itu, menurut kaidah oktet, CO2 adalah molekul yang stabil.
Pengecualian Aturan Oktet
Pengecualian aturan oktet dapat dibagi dalam tiga kelompok sebagai berikut.
1. Senyawa yang tidak mencapai aturan oktet [elektron valensi terlalu sedikit]
Senyawa yang atom pusatnya mempunyai elektron valensi kurang dari 4 termasuk dalam kelompok ini. Hal ini menyebabkan setelah semua elektron valensinya dipasangkan tetap belum mencapai oktet. Contohnya adalah BeCl2, BCl3, dan AlBr3.
| Molekul Senyawa BCl3 |
2. Senyawa yang melampaui aturan oktet [elektron valensi terlalu banyak]
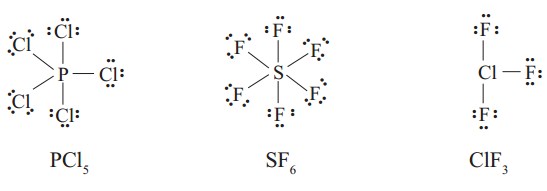
Ini terjadi pada unsur-unsur periode 3 atau lebih yang dapat menampung lebih dari 8 elektron pada kulit terluarnya (ingat, kulit M dapat menampung hingga 18 elektron). Beberapa contoh adalah PCl5, SF6, ClF3, IF7, dan SbCl5.
Perhatikan rumus Lewis dari PCl5, SF6, dan ClF3 berikut ini:
3. Senyawa dengan jumlah elektron valensi ganjil
Contohnya adalah NO2, yang mempunyai elektron valensi (5 + 6 + 6) = 17. Kemungkinan rumus Lewis untuk NO2 sebagai berikut.
| Senyawa NO2 |
Kegagalan Aturan Oktet
Aturan oktet gagal meramalkan rumus kimia senyawa dari unsur transisi maupun postransisi. Unsur postransisi adalah unsur logam setelah unsur transisi, misalnya Ga, Sn, dan Bi. Sn mempunyai 4 elektron valensi, tetapi senyawanya lebih banyak dengan tingkat oksidasi +2. Begitu juga Bi yang mempunyai 5 elektron valensi, tetapi senyawanya lebih banyak dengan tingkat oksidasi +1 dan +3. Pada umumnya, unsur transisi maupun unsur postransisi tidak memenuhi aturan oktet.
Demikian penjelasan mengenai aturan serta pengecualian dan kegagalan oktet. Jadi sekali lagi kami ingatkan bahwa aturan oktet merupakan aturan yang menyatakan bahwa atom dari kelompok unsur utama cenderung berikatan denga atom lain dengan cara memberi ataupun menerima elektron sedemikian rupa sehingga atom yang berikatan memiliki delapan elektron pada kulit terluar atau elektron valensinya. Namun tidak semua unsur yang berikatan memenuhi aturan atau kaidah oktet. Semoga bermanfaat.
Artikel Terkait
- Konfigurasi Elektron Berdasarkan Kaidah Oktet dan Duplet
- Ikatan Kimia : Pembahasan Ikatan Ion dan Kovalen (Part 2)
- Ikatan Kimia : Pembahasan Ikatan Ion dan Kovalen (Part 1)
- Perbedaan Ikatan Hidrogen Dengan Ikatan Van Der Waals
- Pengertian dan Jenis Stoikiometri
- Aturan serta Pengecualian dan Kegagalan Oktet
- Ikatan Kimia : Pengertian, Jenis Ikatan Beserta Contohnya
- Cara Penyetaraan Reaksi Redoks dengan Cara Bilangan Oksidasi (Biloks)
- Cara Penyetaraan Reaksi Redoks dengan Cara Setengah Reaksi atau Ion Elektron
- Pengertian Elektrolit Kuat dan elektrolit Lemah