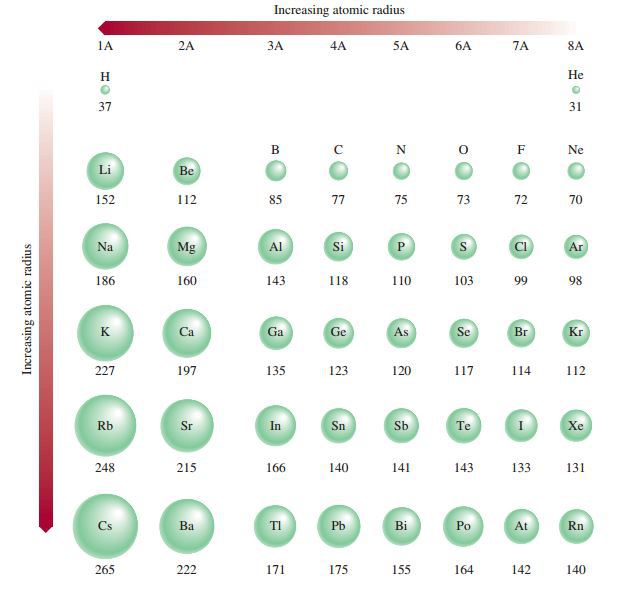
1. Jari-jari atom
Gambar di bawwah ini memperlihatkan data jari-jari atom. Jari-jari atom adalah jarak elektron terluar ke inti atom dan menunjukan ukuran suatu atom. Jari-jari atom sukar diukur sehingga pengukuran jari-jari atom dilakukan dengan cara mengukur jarak inti antardua atom yang berikatan sesamanya.

Pada gambar di atas terlihat bahwa dalam satu golongan, jari-jari atom semakin ke atas cenderung semakin kecil. Hal ini terjadi karena semakin ke atas,kulit elektron semakin kecil. Dalam satu periode, semakin ke kanan jari-jari atom cenderung semakin kecil. Hal ini terjadi karena semakin ke kanan jumlah proton dan jumlah elektron semakin bertambah sedangkan jumlah kulit terluar yang terisi elektron tetap sama sehingga tarikan inti terhadap elektron semakin kuat. Gambar di atas menunjukan keteraturan perubahan jari-jari atom yang merupakan sifat periodik unsur.
2. Keelektronegatifan
Keelektronegatifan adalah besaraan tendensi (kecenderungan) suatu atom untuk menarik elektron. Harga keelektrogenatifan bersifat relatif (berupa harga perbandingan suatu atom terhadap atom yang lain). Salah satu definisi kelektronegatifan adalah definisi Pauling yang menghasilkan data skala kuantitatif seperti pada gambar di bawah.

kecenderungan nilai keelektronegatifan unsur
Dalam satu golongan, harga keelektronegatifan dari bawah ke atas semakin besar. Dalam satu periode, dari kiri ke kanan harga keelektronegatifan semakin besar.
Harga keelektronegatifan peenting untuk menentukan bilangan oksidasi (biloks) unsur dalam suatu senyawa. Jika harga keelektronegatifan besar, berarti unsur yang bersangkutan cenderung menerima elektron dan membentuk bilangan oksidasi negatif. Jika harga keelektronegatifan kecil, unsur cenderun melepaskan elektron dan membentuk bilangan oksidasi positif. Jumlah atom yang diikat bergantung pada elektron valensinya (akan dibahas pada bagian ikatan kimia).
Jadi sifat periodik unsur, keelektronegatifan adalah suatu bilangan yang menggambarkan kecenderungan relatif suatu unsur menarik elektron ke pihaknya dalam suatu ikatan kimia.
3. Energi Ionisasi (Ei)
Energi ionisasi adalah energi minimum yang diperlukan atom netral dalam wujud gas untuk melepas suatu elektron paling luar (yang terikat paling lemah) membentuk ion positif. Pelepasan elektron kedua (dari ion positif satu) disebut energi ionisasi kedua, pelepasan elektron ketiga disebut energi ionisasi ketiga, dan seterusnya. Tahapan pelepasan elektron tersebut dapat digambarkan sebagai berikut:
M(g) → M+(g) + e– Ei-1
M+(g) → M2+(g) + e– Ei-2
Harga energi ionisasi dipengaruhi oleh jari-jari atom dan jumlah elektron valensi atau muatan inti. Semakin kecil jari-jari atom, harga energi ionisasi akan semakin besar. Semakin besar muatan inti, energi ionsasi cenderung akan semakin besar. Perhatikan data energi ionisasi pertama beberapa unsur pada gambar di bawah ini.

Hubungan energi ionisasi dengan nomor atom
4. Afinitas Elektron
Afinitas elektron adalah energi yang dibebaskan oleh siatu atom dalam wujud gas ketika menerima sebuah elektron. Harga afinitas elektron sukar ditentukan secara langsung. Harga afinitas elektron beberapa unsur terlihat pada gambar di bawah ini. Tanda negatif menunjukan energi dilepaskan.
.jpg)
Afinitas elektron unsur-unsur golongan utama
5. Sifat Logam dan Nonlogam
Secara kimia, sifat logam dikaitkan dengan keelektropositifan, yaitu kecenderungan atom melepas elektron untuk membentuk ion positif. Jadi, sifat logam akan bergantung pada energi ionisasi. Semakin besar energi ionisasi, untuk melepas elektron, dan semakin berkurang sifat logamnya. Sebaliknya sifat nonlogam dikaitkan dengan keelektronegatifan, yaitu kecenderungan atom menarik elektron. Sesuai dengan kecenderungan energi ionisasi dan keelektronegatifan yang telah dibahas di atas, maka sifat logam dan nonlogam dalam sistem periodik unsur adalah sebagai berikut:
- Dari kiri ke kanan dalam satu periode,sifat logam berkurang, sedangkan sifat nonlogamnya bertambah.
- Dari atas ke bawah dalam satu golongan, sifat logam bertambah, sedangkan sifat nonlogam berkurang.
Jadi, unsur logam terletak pada bagian kiri-bawah sistem periodik unsur, sedangkan unsur nonlogam terletak pada bagian kanan-atas. Akan tetapi, yang paling bersifat nonlogam adalah golongan VIIA, bukan golongan VIIIA. Unsur yang terletak pada bagian tengah, yaitu unsur yang terletak di daerah perbatasan antara logam dan nonlogam, mempunyai sifat logam sekaligus sifat nonlogam. Unsur-unsur itu disebut unsur metaloid. Contohnya boron dan silikon.
6. Kereaktifan (kemudahan berekasi)
Kereaktifan suatu unsur bergantung pada kecenderungannya melepas atau menarik elektron. Jadi, unsur logam yang paling reaktif adalah golongan IA (logam alkali), sedangkan nonlogam yang paling reaktif adalah golongan VIIA (halogen). Dari kiri ke kanan dalam satu periode,mula-mula kerekatifan menurun kemudian bertambah hingga ke golongan VIIA. Golongan VIIIA tidak reaktif.
Demikian tulisan mengenai sistem periodik unsur.. Semoga bermanfaat…