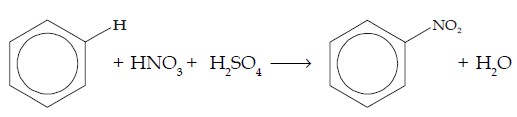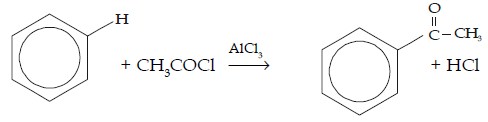Reaksi Adisi, Substitusi Pada Benzena dan Reaksi Eliminasi
a. Reaksi adisi
Reaksi adisi adalah reaksi penggabungan dua atau lebih molekul membentuk suatu produk tunggal yang ditandai dengan hilangnya ikatan rangkap. Reaksi ini merupakan reaksi karakteristik dari senyawa tak jenuh seperti alkena dan alkuna.
Setelah mengalami reaksi adisi, alkena akan berubah menjadi senyawa jenuh alkana. Secara umum, reaksi adisi pada alkena dapat diilustrasikan seperti berikut.

Pada umumnya, reaksi adisi mengikuti aturan Markovnikov. Aturan Markovnikov menyatakan bahwa pada reaksi adisi hidrogen halida (HX), atom halogen (X) akan terikat pada atom karbon yang paling sedikit mengikat atom H, sedangkan atom hidrogen (H) akan terikat pada atom karbon yang paling banyak mengikat atom H (“yang kaya semakin kaya”).
Jika atom karbon yang berikatan rangkap tersebut mempunyai jumlah atom H terikat sama banyak, maka atom X akan cenderung terikat pada atom karbon dengan gugus alkil yang lebih panjang.
Baca juga: Rumus Kimia Benzena, Pengertian, Sifat, Kegunaan, dan Bahaya Benzena
Berikut beberapa contoh reaksi adisi:

Senyawa yang memiliki ikatan rangkap biasanya lebih mudah mengalami reaksi adisi. Misalnya, senyawa hidrokarbon kelompok alkena. Akan tetapi, hal tersebut tidak berlaku untuk benzena.
Meskipun benzena memiliki ikatan rangkap, namun benzena lebih mudah mengalami reaksi substitusi. Reaksi subtitusi yang dimaksud di sini yaitu reaksi substitusi satu (monosubstitusi) dan reaksi substitusi kedua dimana keduanya bisa saja menjadi rangkaian reaksinya.
b. Reaksi Substitusi
Reaksi Substitusi yaitu reaksi penggantian atom atau gugus atom dalam suatu molekul dengan atom atau gugus atom lainnya. Penggantian gugus nukleofil disebut substitusi nukleofilik.
Penggantian gugus elektrofil disebut substitusi elektrofilik. Gugus nukleofil tidak dapat digantikan dengan gugus elektrofil, demikian juga sebaliknya. Secara umum, reaksi substitusi dapat dituliskan sebagai:
R−Q + PX → R−X + PQ
di mana gugus Q dan X keduanya nukleofil atau keduanya elektrofil.
Reaksi Benzena
Sebelumnya telah dijelaskan bahwa reaksi subtitusi benzena terbagi menjadi dua golongan reaksi yakni reaksi substitusi satu (monosubstitusi) dan reaksi substitusi kedua. Bagaimanakah reaksi substitusi pada benzena itu terjadi? Nach berikut penjelasannya khusus sahabat:
1. Reaksi Substitusi Satu (Monosubstitusi) Benzena
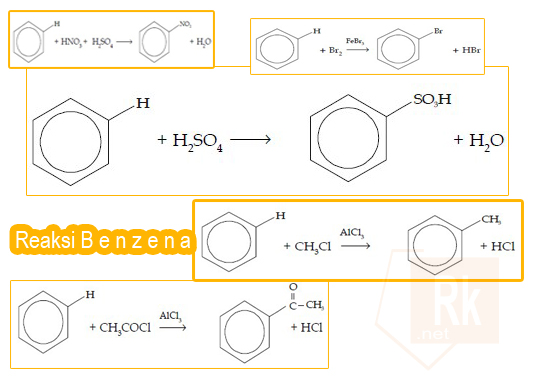
Reaksi substitusi 1 atom H pada benzena oleh 1 atom/molekul lainnya disebut reaksi monosubstitusi. Ada beberapa reaksi monosubstitusi, di antaranya reaksi halogenasi, nitrasi, sulfonasi, alkilasi, dan asilasi.
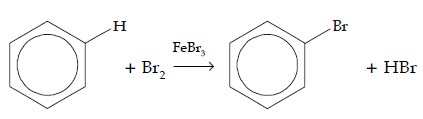
a. Reaksi Halogenasi
Pada reaksi halogenasi, atom H digantikan oleh atom halogen, seperti Br, Cl, dan I. Pereaksi yang digunakan adalah gas Br2, Cl2, dan I2 dengan katalisator besi(III) halida.
|
|
Nama senyawa yang terbentuk bergantung pada atom halogen yang mensubstitusi atom H. Perhatikanlah tabel berikut.
| Nama Senyawa Hasil Reaksi Halogenasi | ||
| Atom Halogen | Rumus Kimia | Nama |
| Br | C6H5Br | Bromobenzena |
| Cl | C6H5Cl | Klorobenzena |
| I | C6H5I | Iodobenzena |
b. Reaksi Nitrasi
Pada reaksi nitrasi, atom H digantikan oleh gugus nitro (NO2). Pereaksi yang digunakan adalah asam nitrat pekat (HNO3) dengan katalisator asam sulfat pekat (H2SO4).
c. Reaksi Sulfonasi
Pada reaksi sulfonasi, atom H digantikan oleh gugus sulfonat (SO3H). Pereaksi yang digunakan adalah asam sulfat berasap (H2SO4 + SO3) pada suhu 40 °C.
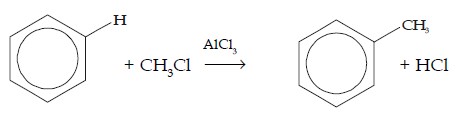
d. Reaksi Alkilasi
Pada reaksi alkilasi, atom H digantikan oleh gugus alkil (CnH2n+1). Pereaksi yang digunakan adalah alkil halida dengan katalisator aluminium klorida (AlCl3).
|
|
Nama senyawa yang terbentuk bergantung pada gugus alkil yang mensubstitusi atom H. Berikut contoh penamaan alkil benzena.
| Nama Senyawa Hasil Reaksi Alkilasi | ||
| Atom Halida | Rumus Kimia | Nama |
| CH3Cl | C6H5CH3 | Metilbenzena |
| CH3CH2Cl | C6H5CH2CH3 | Etilbenzena |
| CH3CH2CH2Cl | C6H5CH2CH2CH3 | Propilbenzena |
e. Reaksi Asilasi
Pada reaksi asilasi, atom H digantikan oleh gugus asil (CH3C=O). Pereaksi yang digunakan adalah halida asam, seperti CH3COCl (asetil klorida) dan CH3CH2C=OCl (propanoil klorida) dengan katalisator aluminium klorida (AlCl3).
| Nama Senyawa Hasil Reaksi Asilasi | ||
| Gugus Asil | Rumus Kimia | Nama |
| CH3COCl | C6H5COCH3 | Asetofenon |
| CH3CH2COCl | C6H5COCH2CH3 | Fenil etil keton |
2. Reaksi Substitusi Kedua Benzena
Senyawa turunan benzena yang dihasilkan dari reaksi monosubstitusi dapat mengalami substitusi kedua. Bagaimanakah struktur dan tata nama senyawa turunan benzena yang mengalami substitusi kedua? Berikut ulasan sederhananya:
Ada 3 kemungkinan struktur senyawa turunan benzena yang mengalami substitusi kedua, yaitu posisi 1 dan 2, posisi 1 dan 3, serta posisi 1 dan 4.
Baca juga: 7 Penjelasan Aturan Tata Nama Benzena Dilengkapi Contoh
Senyawa turunan benzena yang posisi atom-atom substituennya terletak pada cincin nomor 1 dan 2 disebut senyawa orto (disingkat o). Senyawa turunan benzena yang posisi atom-atom substituennya terletak pada cincin nomor 1 dan 3 disebut senyawa meta (disingkat m).
Senyawa turunan benzena yang posisi atom-atomnya terletak pada cincin nomor 1 dan 4 disebut senyawa para (disingkat p).
Bagaimanakah cara memberi nama senyawa-senyawa turunan benzena yang mengalami substitusi kedua? Perhatikanlah contoh-contoh berikut ini:
|
|
Demikian penjelasan mengenai Reaksi Benzena dalam hal ini reaksi subtitusi yang terjadi pada senyawa benzena beserta turunannya.
c. Reaksi Eliminasi
Reaksi Eliminasi yaitu reaksi penghilangan dua substituen dari suatu molekul. Pada dasarnya, reaksi eliminasi dapat dianggap sebagai kebalikan dari reaksi adisi. Reaksi eliminasi biasanya ditandai dengan berubahnya ikatan tunggal menjadi ikatan rangkap melalui terlepasnya molekul kecil seperti air, HCl, atau HBr.
Pada umumnya, reaksi eliminasi mengikuti aturan Zaitsev. Aturan Zaitsev menyatakan bahwa atom H yang tereliminasi merupakan atom H yang terikat pada atom karbon yang paling sedikit mengikat hidrogen (“yang miskin semakin miskin”).
Berikut beberapa contoh reaksi eliminasi.

Artikel Terkait
- Introductions (Perkenalan)
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?