Polarisasi Ikatan Kovalen Beserta Rumusnya
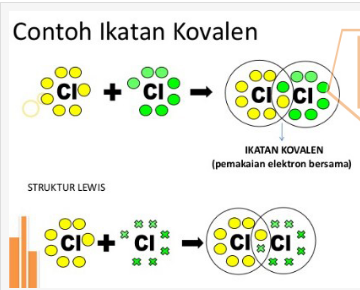
Kedudukan pasangan elektron ikatan tidak selalu simetris terhadap kedua atom yang berikatan. Hal ini disebabkan karena setiap unsur mempunyai daya tarik elektron (keelektronegatifan) yang berbeda-beda. Salah satu akibat dari keelektronegatifan adalah terjadinya polarisasi pada ikatan kovalen. Ikatan kovalen merupakan ikatan yang terjadi akibat adanya pemakaian bersama pasangan elektron.
Polarisasi Ikatan Kovalen
Selain keelektronegatifan, terdapat beberapa faktor lain yang menyebabkan suatu molekul bersifat polar ataukah bersifat nonpolar seperti momen dipol, momen ikatan, momen pasangan elektron bebas, kation, anion, serta konfigurasi elektron.
Perhatikan kedua contoh berikut ini:
Pada contoh (a), kedudukan pasangan elektron ikatan sudah pasti simetris terhadap kedua atom H. Dalam molekul H2 tersebut muatan negatif (elektron) tersebar homogen. Hal ini dikenal dengan ikatan kovalen nonpolar. Pada contoh (b), pasangan elektron ikatan tertarik lebih dekat ke atom Cl karena Cl mempunyai daya tarik elektron lebih besar daripada H. Hal ini menyebabkan adanya polarisasi pada HCl, di mana atom Cl lebih negatif daripada atom H. Ikatan seperti ini dikenal dengan ikatan kovalen polar.
Rumus Menentukan Kepolaran suatu Molekul
Untuk menentukan kepolaran suatu molekul, baik molekul senyawa maupun molekul unsur dapat menggunakan persamaan. Kepolaran dinyatakan dengan momen dipol (μ), yaitu hasil kali antara muatan (Q) dengan jarak (r). Berikut persamaannya:
μ = Q × r
Keterangan:
-
µ = momen dipol (D, atau debye)
-
Q = selisih muatan (coulomb atau ditulis C)
-
r = jarak antara muatan positif dengan muatan negatif (meter, atau ditulis m)
Satuan momen dipol adalah debye (D), di mana 1 D = 3,33 × 10–30 coulomb.meter. Momen dipol dari beberapa senyawa diberikan dalam tabel berikut:
| NO. | Molekul | Momen Dipol (D, debye) | Sifat |
| 1 | BF2 | 0 | Nonpolar |
| 2 | BF3 | 0 | Nonpolar |
| 3 | Br2 | 0 | Nonpolar |
| 4 | CCl4 | 0 | Nonpolar |
| 5 | CH4 | 0 | Nonpolar |
| 6 | Cl2 | 0 | Nonpolar |
| 7 | CO2 | 0 | Nonpolar |
| 8 | COCl2 | 0 | Nonpolar |
| 9 | H2 | 0 | Nonpolar |
| 10 | I2 | 0 | Nonpolar |
| 11 | PCl5 | 0 | Nonpolar |
| 12 | SF6 | 0 | Nonpolar |
| 13 | HBr | 1,078 | Polar |
| 14 | CO | 0,112 | Polar |
| 15 | NO | 0,15 | Polar |
| 16 | AsH3 | 0,2 | Polar |
| 17 | NF3 | 0,23 | Polar |
| 18 | NO2 | 0,32 | Polar |
| 19 | HI | 0,38 | Polar |
| 20 | H2S | 0,44 | Polar |
| 21 | PH3 | 0,58 | Polar |
| 22 | PCl3 | 0,78 | Polar |
| 23 | CO2 | 0,95 | Polar |
| 24 | HCl | 1,03 | Polar |
| 25 | CHCl3 | 1,09 | Polar |
| 26 | SOCl2 | 1,45 | Polar |
| 27 | AsCl3 | 1,59 | Polar |
| 28 | NH3 | 1,62 | Polar |
| 29 | N2H4 | 1,75 | Polar |
| 30 | HF | 1,78 | Polar |
| 31 | SO2Cl2 | 1,81 | Polar |
| 32 | H2O | 1,82 | Polar |
| 33 | SO2 | 1,84 | Polar |
| 34 | F2NH | 1,92 | Polar |
| 35 | HNO3 | 2,17 | Polar |
| 36 | H2O2 | 2,2 | Polar |
[Catatan: Jika sahabat menemukan kekeliruan dalam nilai momen dipol dari molekul di atas, mohon saran dari sahabat lewat form komentar. Terima kasih]
Molekul Polar dan Nonpolar
Suatu senyawa yang memiliki ikatan kovalen polar, belum tentu molekul yang dimiliki bersifat polar. Demikian juga untuk ikatan kovalen nonpolar, molekul yang dimiliki belum tentu bersifat nonpolar. Kepolaran suatu molekul dinyatakan menggunakan suatu besaran yang disebut momen dipol (µ). Berikut ketentuan sebuah molekul dinyatakan memiliki sifat nonpolar dan polar:
µ = 0 → molekul nonpolar
µ > 0 atau µ ≠ 0 → molekul polar
Demikian penjelasan yang dapat kami bagikan pada kesempatan kali ini mengenai polarisasi ikatan kovalen. Jadi penentuan polar dan nonpolarnya sebuah molekul baik molekul senyawa maupun molekul unsur ditentukan dengan melihat nilai dari momen dipole dengan ketentuan nilai µ = 0 dikatakan molekul bersifat nonpolar, sedangkan jika nilai µ > 0 atau µ ≠ 0 dikatakan molekul bersifat polar. Jika sahabat ingin memahami lebih jauh mengenai sifat molekul polar dan sifat nonpolar, sahabat dapat membaca Ikatan Kovalen (Polar Dan Nonpolar) Beserta Contoh Ikatannya. Semoga bermanfaat.
Artikel Terkait
- Introductions (Perkenalan)
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?
