Perbedaan Gas Ideal Dengan Gas Nyata
Gas merupakan salah satu kondisi yang dipunyai oleh materi. Gas mempunyai sifat kontradiktif dengan padatan dan juga cairan. Gas tidak mempunyai urutan, dan mereka menduduki setiap ruang yang diberikan.

Kegiatan mereka dipengaruhi oleh variabel seperti temperatur, tekanan, dan lain – lain. Gas ideal merupakan konsep teoritis, yang digunakan dengan tujuan penelitian. Agar gas menjadi ideal, mereka harus mempunyai karakteristik seperti apabila salah satu dari ini hilang, maka gas itu tidak dianggap sebagai gas ideal.
Apabila anda ingin menghindari terjadinya kebocoran gas anda bisa memakai alat pendeteksi kebocoran gas. Sebagai informasi di alat ukur indonesia juga menjual alat pendeteksi kebocoran gas dan alat ukur lainnya dengan kualitas yang bagus.
Baca juga: Persamaan Umum Gas Ideal Lengkap dengan Contoh Soal
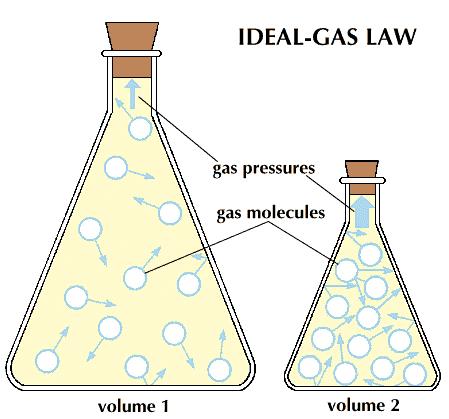
Gaya molekul Inter antara molekul gas bisa diabaikan. Molekul gas dianggap partikel titik. Oleh sebab itu, dibanding dengan ruang di mana molekul gas menduduki, volume molekul tidak signifikan. Molekul gas biasanya mengisi setiap ruang yang diberikan.
Sebab itu, saat ruang besar diduduki oleh udara, molekul gas tersebut sangat kecil dibanding dengan ruang. Oleh sebab itu, dengan asumsi molekul gas sebagai partikel titik sejati sampai suatu batas tertentu. Tetapi ada beberapa molekul gas dengan volume yang lumayan besar.
Mengabaikan volume menghasilkan kesalahan pada hal ini. Pertama, kita harus mempertimbangkan tidak ada kaitan antar molekul dan juga antara molekul gas. Tetapi kenyataannya, ada interaksi setidaknya lemah antar mereka. Namun, molekul gas bergerak secara acak dan cepat.
Oleh sebab itu, mereka tidak mempunyai cukup waktu untuk membuat interaksi antar molekul dengan molekul lainnya. Sebab itu, saat melihat di sudut ini. Walaupun kita menyatakan gas yang ideal merupakan teoritis, kita tidak dapat mengatakan itu 100 persen benar. Ada kesempatan untuk gas bertindak sebagai gas ideal.
Tekanan, volume dan suhu adalah variabel yang menandai gas ideal. Sebuah gas nyata bervariasi dari keadaan ideal pada tekanan yang tinggi. Ini dikarenakan saat tekanan yang tinggi diterapkan, di mana volume gas diisi menjadi sangat kecil. Kemudian dibanding dengan ruang kita tidak dapat mengabaikan ukuran molekul.
Selain itu, gas ideal berada dalam kondisi sesungguhnya pada suhu yang rendah. Energi kinetik molekul gas sangat rendah jika pada suhu rendah. Oleh sebab itu, mereka bergerak secara perlahan. Sebab itu, ada interaksi antar molekul dan antara molekul gas, yang tidak dapat kita abaikan.
Perbedaan gas ideal dengan gas nyata:
1.Gas ideal tidak mempunyai gaya antarmolekul dan molekul gas dianggap partikel titik. Sebaliknya molekul gas nyata mempunyai ukuran dan volume. Selanjutnya mereka mempunyai gaya antarmolekul.
2.Gas ideal tidak bisa ditemukan di kenyataan. Namun gas berperilaku dengan cara ini di suhu dan tekanan tertentu.
3.Gas cenderung berperilaku sebagai gas nyata di tekanan tinggi dan suhu rendah. Gas nyata berperilaku sebagai ideal di tekanan rendah dan juga suhu tinggi.
4.Gas ideal bisa berkaitan dengan persamaan PV = nRT = NKT, sedangkan gas nyata tak bisa. Untuk menentukan gas nyata, ada persamaan yang jauh lebih rumit.
Artikel Terkait
- Introductions (Perkenalan)
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?