Pengertian Atom Rutherford, Teori, Kelebihan dan Kekurangan
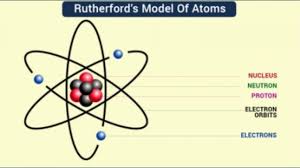
Atom ini merpuakan suatu satuan dasar materi, yang terdiri dari inti atom dan juga awan elektron yang bermuatan negatif yang akan mengelilinginya. Inti atom ini terdiri dari proton yang bermuatan positif, atau juga neutron memiliki muatan netral.
Elektron-elektron pada sebuah atom ini bisa terikat pada inti atom oleh gaya elektromagnetik. Dari beberapa sekumpulan atom demikian juga bisa berhubungan satu sama lainnya, serta juga dapat membentuk sebuah molekul. Atom yang mengandung jumlah proton serta elektron yang sama memiliki sifat netral,lalu sedangkan yang mengandung jumlah proton atau juga elektron yang berbeda bersifat positif atau juga negatif sering disebut ialah sebagai ion. Atom ini juga dikelompokkan dengan berdasarkan jumlah proton serta neutron yang terdapat pada inti atom tersebut. Jumlah proton pada atom tersebut akan menentukan unsur kimia atom tersebut, serta jumlah neutron menentukan isotop unsur tertentu.
Dasar Teori Atom Ernerst Rutherford
Setelah Teori Atom Jhon Dalton itu disangkal serta juga kemudian diperbaiki oleh Jj. Thomson ini menyatakan bahwa atom tersebut seperti Roti Kismis,yang Selanjutnya giliran Rutherford yang bisa menyangkal kebenaran teori atom Thomsom.

Yang dikala itu Rutherford mengatakan bahwa atom tersebut mempunyai sebuah inti pusat atau sering disebut nekleus dengan dikelilingi awan elektron memiliki muatan negatif.
Teori atom Rutherford tersebut didasarkan pada eksperimen penembakan inti atom lempengan emas pada partikel alfa yang sering dikenal dengan sebutan percobaan Geiger-Marsden. di watu itu, Rutherford tersebut akan menyusun desain rancangan percobaan penembakan atom emas oleh partikel alfa yang sudah dipancarkan oleh unsur radio aktif.nah Ternyata, sinar radio aktif tersebut ada yang telah dipantulkan, dibelokkan, atau juga diteruskan. Rutherford tersebut lalu menjelaskan bahwa apabila partikel alfa tersebut mengenai inti atom, maka akan terjadi tumbukan yang menyebapkan pembelokan ataujuga pemantulan partikel alfa. Hal ini disebabkan oleh karena massa serta juga muatan atom yang terpusat pada inti nukleus. Rutherford tersebut lalu menyarankan bahwa muatan inti atom itu akan sebanding dengan massa atom di dalam SMA /satuan masa atom. Partikel alfa yang mengenai awan elektron tersebut tidak akan dibelokkan atau dipantulkan.
Dari hasil pemahamannya dengan melaui eksperimennya tersebut, Ernerst Rutherfordutherford tersebut akhirnya menyimpulkan serta menyatakan bahwa:
- Sebagian besar volume atom itu merupakan ruang hampa.
- Massa atom akan terpusat pada inti atom (nukleus).
- Muatan atom tersebut dapat terkonsentrasi pada pusat atom dengan volume yang lumayan kecil. Kelipatan muatan itu sebanding dengan massa atom.
Dengan melalui pernyataannya E. Rutherford ini bisa menyangkal bahwa atom itu bukanlah seperti roti kismis melainkan juga seperti susunan planet yang mengorbit matahari. Yang mana matahari tersebut akan diumpamakan ialah sebagai inti pusat yang bermuatan positif (nukleus) atau juga susunan planet yang diumpakanya ialah sebagai muatan negatif, oleh karena itu, teori atom Dalton serta juga Thomson yang memiliki kelebihan ataupun kelemahannya, Teori atom E. Rutherford ini juga mempunyai kelebihan dan kelemahannya. Dibawah ini merupakan kelebihan serta kelemahan dari teori atom E. Rutherford.
Kelebihan dan Kekurangan Teori Atom Ernerst Rutherford.
Adapun Kelebihan dan Kekurangan Teori atom ernerst rutherford ini ialah sebagai berikut :
Kelebihan Teori Atom Ernerst Rutherford
- Mudah dipahami untuk dapat menjelaskan struktur atom yang sangat rumit
- Dapat menjelaskan bentuk dari suatu lintasan elektron yang mengelilingi inti atom
- Bisa menggambarkan gerak elektron disekitar inti
Kekurangan Teori Atom Ernerst Rutherford
- Model atom rutherford ini belum mampu untuk menjelaskan dimana letak elektron serta juga cara rotasinya terhadap ini atom.
- Elektron ini dapat memancarkan energi pada saat bergerak,lalu sehingga energi atom menjadi tidak stabil.
- Tidak bisa menjelaskan spektrum garis pada atom hidrogen (H).
Sekian dan terima kasih sudah membaca mengenai Pengertian Atom Rutherford, Teori, Kelebihan dan Kekurangan, Semoga apa yang diuraikan dapat bermanfaat untuk anda.
Artikel Terkait
- Introductions (Perkenalan)
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?