Penemuan Model Atom dan Partikel Penyusunnya
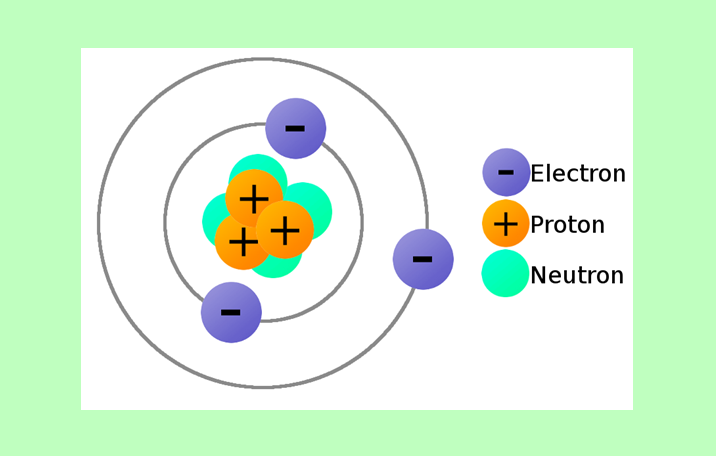
Atom adalah unit dasar dan bahan bangunan dari suatu unsur. Atom memulai reaksi dan proses kehidupan yang penting yang terjadi di sekitar kita. Atom adalah unit dasar dari setiap substansi yang menempati ruang dan memiliki massa dan volume yang pasti. Sebuah atom terdiri dari tiga partikel utama sub-atom yaitu proton, elektron dan neutron. Elektron membentuk awan di sekitar inti dan terikat ke inti oleh kekuatan elektromagnetik. Di tengah-tengah atom adalah inti yang mengandung proton dan neutron, secara kolektif disebut nukleon. Nukleon terdiri dari partikel yang disebut quark yang diselenggarakan bersama oleh kekuatan yang kuat yang ditengahi oleh gluon. Sebuah atom tidak memiliki struktur dan batas yang pasti. Di sini, kita akan mencoba untuk mengambil secara singkat melihat setiap partikel dan memahami perannya dalam atom. Perhatikan Model Atom Bohr berikut:
Atom adalah bagian terkecil dari suatu unsur yang masih mempunyai sifat yang sama dengan unsur tersebut.
Atom terdiri dari :
Proton : bermuatan positif
Elektron : bermuatan negatif
Neutron : tidak bermuatan ( netral )
MODEL ATOM
A. MODEL ATOM JOHN DALTON
- atom adalah bagian terkecil suatu unsur
- atom tidak dapat diciptakan, dimusnahkan, terbagi lagi, atau diubah menjadi zat lain -atom-atom suatu unsur adalah sama dalam segala hal, tetapi berbeda dengan atom-atom dari unsur lain
- reaksi kimia merupakan proses penggabungan atau pemisahan atom dari unsur-unsur yang terlihat.
Kelebihan
Mulai membangkitkan minat terhadap penelitian mengenai model atom
Kelemahan
Teori atom Dalton tidak dapat menerangkan suatu larutan dapat menghantarkan arus listrik. Bagaimana mungkin bola pejal dapat menghantarkan arus listrik? padahal listrik adalah elektron yang bergerak. Berarti ada partikel lain yang dapat menghantarkan arus listrik.
B. MODEL ATOM J.J. THOMPSON
atom merupakan suatu bolabermuatan positif dan di dalamnya tersebar elektron-elektron seperti kismis. jumlah muatan positif sama dengan muatan negatif, sehingga atombersifat netral.
Kelebihan
Membuktikan adanya partikel lain yang bermuatan negatif dalam atom. Berarti atom bukan merupakan bagian terkecil dari suatu unsur.
Kelemahan
Model Thomson ini tidak dapat menjelaskan susunan muatan positif dan negatif dalam bola atom tersebut.
C. MODEL ATOM RUTHERFORD
atom terdiri dari inti atom yang sangatkecil dengan muatan positif yang massanya merupakan massa atom tersebut elektron-elektron dalam atom bergerak mengelilingi inti tersebut banyaknya elektron dalam atom sama dengan banyaknya proton dalaminti dan ini sesuai dengan nomor atomnya.
Kelebihan
Membuat hipotesa bahwa atom tersusun dari inti atom dan elektron yang mengelilingi inti
Kelemahan
Tidak dapat menjelaskan mengapa elektron tidak jatuh ke dalam inti atom. Berdasarkan teori fisika, gerakan elektron mengitari inti ini disertai pemancaran energi sehingga lama – kelamaan energi elektron akan berkurang dan lintasannya makin lama akan mendekati inti dan jatuh ke dalam inti Ambilah seutas tali dan salah satu ujungnya Anda ikatkan sepotong kayu sedangkan ujung yang lain Anda pegang. Putarkan tali tersebut di atas kepala Anda. Apa yang terjadi? Benar. Lama kelamaan putarannya akan pelan dan akan mengenai kepala Anda karena putarannya lemah dan Anda pegal memegang tali tersebut. Karena Rutherford adalah telah dikenalkan lintasan/kedudukan elektron yang nanti disebut dengan kulit.
D. MODEL ATOM BOHR
- elektron-elektron dalam mengelilingi intiberada pada tingkat-tingkat energi (kulit) tertentu tanpa menyerap atau memancarkan energi
- elektron dapat berpindah dari kulit luar ke kulit yang lebih dalam denganmemancarkan energi, atau sebaliknya.
Kelebihan
atom Bohr adalah bahwa atom terdiri dari beberapa kulit untuk tempat berpindahnya elektron.
Kelemahan
model atom ini adalah tidak dapat menjelaskan efek Zeeman dan efek Strack.
Pertikel Penyusun Atom
1. Elektron
Ditemukan oleh JJThomson pada tahun 1897, sebuah elektron adalah partikel subatomik yang paling ringan yang terikat ke inti dengan gaya tarik-menarik antara elektron negatif dan proton bermuatan positif. Sebagian besar atom adalah ruang kosong di mana elektron mengorbit di sekitar inti dan mencoba untuk mencapai keadaan stabil. Elektron memainkan peran penting dalam banyak fenomena fisik seperti listrik, magnet dan konduktivitas termal.
2. Neutron
Neutron tidak memiliki muatan atau netral dan pada tahun 1932, seorang ahli fisika Inggris James Chadwick menemukan bahwa itu terletak pada inti. Neutron lebih lanjut terdiri dari partikel fundamental yang disebut quark. Hal ini terdiri dari 1 ke atas dan 2 quark ke bawah. Quark membawa nilai pecahan muatan dan karenanya menentukan muatan partikel.
1 quark atas = muatan ⅔ e dan quark bawah = muatan – ⅓ e.
Oleh karena itu muatan neutron = ⅔ + (- ⅓ – ⅓) = 0.
Dengan demikian, neutron tidak memiliki muatan.
3. Proton
Jumlah proton yang hadir dalam inti atom dikenal sebagai nomor atom unsur. Massa atom terkonsentrasi di inti yang terdiri dari proton dan neutron. Massa proton dan neutron hampir sama, namun itu adalah 1.836 kali lebih berat daripada elektron. Muatan positif antara proton menyebabkan mereka saling tolak. Sebuah gaya nuklir kuat memegang proton bersama-sama. Gaya ini diberikan oleh kehadiran quark down 2 dan 1 dalam proton.
Muatan pada proton = 2 (⅔) + (- ⅓) = 1.
Dengan demikian, proton memperoleh muatan positif.
Pengertian Nomor Massa dan Nomor Atom
Massa atom suatu unsur merupakan massa relatif unsur dibandingkan massa sebuah atom hidrogen. Banyaknya proton di dalam inti atom disebut nomor atom yang diberi lambang Z.
Pada atom netral, banyaknya proton dalam inti sama dengan banyaknya elektron sehingga nomor atom merupakan banyaknya elektron yang beredar mengelilingi inti atom.
Banyaknya proton dan neutron di dalam inti atom disebut nomor massa yang diberi lambang A. Jika lambang atom adalah X maka penulisan sebuah atom menjadi;

Contoh :
Berapa jumlah neutron dalam atom neon yang memiliki nomor massa = 20 dan nomor atom = 10?
Jawab:
Nomor massa (A) = jumlah proton (p) + jumlah neutron (n)
Karena jumlah proton = nomor atom, maka dapat ditulis:
Nomor massa (A) = nomor atom (Z) + jumlah neutron (n)
20 = 10 + n, atau n = 20 – 10 = 10
Jadi jumlah neutron dalam atom neon adalah 10
Artikel Terkait
- Introductions (Perkenalan)
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?