PENURUNAN TEKANAN UAP
Untuk memahami fenomena penurunan tekanan uap, mari kita simak terlebih dahulu pengertian tekanan uap pada pelarut murni, dan bagaimana besarnya tekanan uap tersebut akan dipengaruhi oleh penambahan zat terlarut ke dalam pelarut murni.
PENURUNAN TEKANAN UAP
1. Tekanan uap Pelarut Murni (Po)
Perhatikan gambar di bawah ini
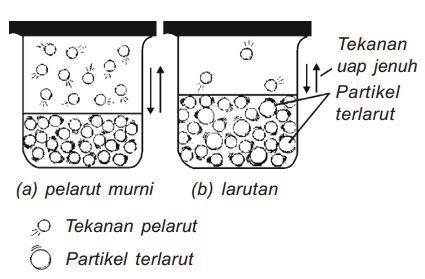
Pada awalnya terjadi perpindahan partikel dari fase cair ke gas, namun pada akhirnya terjadi keseimbangan dengan perpidahan partikel dari fase gas ke fase cair
Jika pelarut murni dimasukkan ke dalam suatu tempat tertutup, maka akan terjadi perpindahan partikel dari fase cair ke fase gas dan sebaliknya. Jumlah partikel pelarut murni pada fase gas memberikan suatu tekanan yang disebut tekanan uap. Setelah beberapa waktu, jumlah partikel pelarut murni yang melepaskan diri dari fase cair ke fase gas sama dengan jumlah partikel pelarut murni di fase gas yang terperangkap di permukaan fase cair. Pada keadaan ini, dikatakan kesetimbangan dinamis telah tercapai. Secara umum, tekanan uap dapat didefinisikan sebagai berikut:
Tekanan uap adalah tekanan gas yang berada di atas zat cairnya di dalam teempat tertutup, dimana gas dan zat cair berada dalam kesetimbangan dinamis.
2. Tekanan uap larutan (Plarutan)
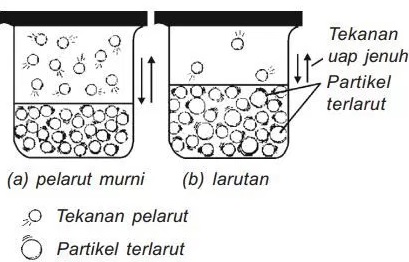
Apabila ke dalam pelarut murni di atas ditambahkan sejumlah zat terlarut, apa yang akan terjadi pada nilai tekanan uap larutan?

| (a) Tekanan uap pelarut murni (Po) | (b) Tekanan uap larutan (Plarutan) |
| Jumlah partikel pelarut di permukaan lebih banyak dibandingkan (b) | Jumlah partikel pelarut di permukaan lebih sedikit dibandingkan (a) karena adanya zat terlarut |
| Kesempatan partikel-partikel di permukaan untuk lepas ke fase gas lebih besar | Lebih sedikit partikel pelarut yang pergi ke fase gas dibandingkan (a) |
| Partikel pelarut di fase gas membentuk tekanan uap | Partikel pelarut yang pergi ke fase gas tidak sebanyak di A sehingga tekanan uap B lebih kecil dibandingkan (a). |
Dari penjelasan di atas, kita bisa melihat bahwa tekanan uap larutan (Plarutan) ternyata lebih kecil dibandingkan tekanan uap pelarut murninya (Popelarut). Inilah sebenarnya yang dimaksud dengan penurunan tekanan uap (∆P) larutan.
Baca Juga :
PENURUNAN TITIK BEKU LARUTAN DAN APLIKASINYA
Air Panas Lebih Cepat Beku ketimbang Air Dingin, Benarkah?
Secara umum, penurunan tekanan uap didefinisikan sebagai berikut.
Penurunan tekanan uap (∆P) adalah berkurangnya tekanan uap suatu larutan relatif terhadap tekanan uap pelarut murninya.
Nilai (∆P) dapat dihitung dari tekanan uap larutan yang dijabarkan oleh Francois Raoult dan dikenal sebagai Hukum Raoult.
Plarutan = Xpelarut Popelarut
Dengan demikian, penurunan tekanan uap larutan (∆P) data ditulis sebagai:
∆P = Popelarut – Plarutan
= Popelarut – (Xpelarut Popelarut)
= Popelarut (1 – Xpelarut)
∆P = Popelarut Xzat terlarut
dengan: ∆P = penurunan tekanan uap
Popelarut = tekanan uap pelarut murni
Xzat terlarut = Fraksi mol zat terlarut
Larutan yang mematuhi Hukum Raoult sepenuhnya disebut larutan ideal. Pada kenyataannya, hanya larutan non-ideal yang kita temui. Oleh karena itu, penerapan Hukum Raoult merupakan suatu pendekatan selama larutan tersebut encer dan zat terlarutnya tidak mudah menguap. Keenceran larutan penting agar jarak antar-partikel tidak terlalu dekat sehingga partikel dapat bergerak bebas. Sementara itu zat terlarut tidak mudah menguap dimaksudkan agar partikel zat terlarut tidak pergi ke fase gas dan memberi tambahan tekanan uap.
Contoh soal Penurunan tekanan uap
Sebanyak 5 gram lilin C22H46 dilarutkan dalaam 50 gram karbon tetra klorida (CCl4) pada suhu 23oC. Hitung besarnya penurunan tekanan uap larutan. (PoCCl4 pada 23oC = 0,131 atm; Mr C22H46 = 310; dan MrCCl4 = 154).
Jawab:
Mol CCl4 = massa CCl4 / Mr CCl4 = 50 gram / 154g/mol = 0,325 mol
Mol C22H46 = massa C22H46 / Mr C22H46 = 5g / 310g/mol = 0,016 mol
Penurunan tekanan uap larutan,
∆Plarutan = Popelarut Xzat terlarut = 0,131 atm x (0,016 mol/ (0,016 mol + 0,325 mol)) = 0,006 atm
Demikian ulasan mengenai penurunan tekanan uap . Semoga bermanfaat…..
Artikel Terkait
- Introductions (Perkenalan)
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?