NOTASI SEL VOLTA
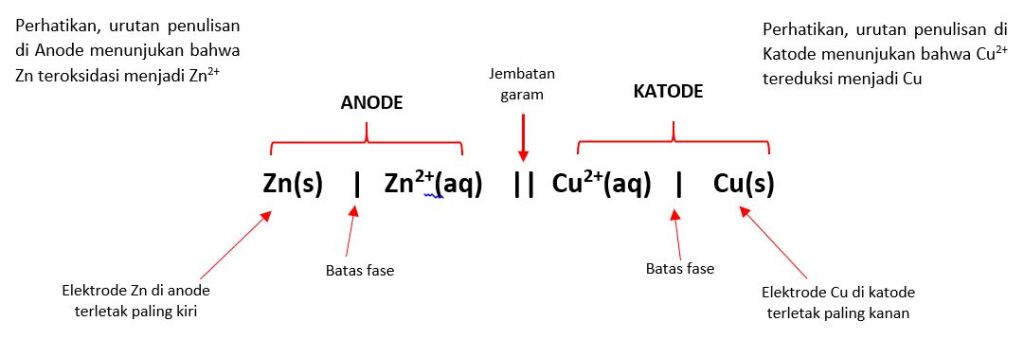
Notasi sel volta digunakan untuk menggambarkan rangkaian sel volta dan reaksi redoks yang berlangsung didalamnya.Sel Volta tersusun atas setengah sel antara logam seng – ion seng dan setengah sel antar logam tembaga-ion tembaga. Sel tersebut dapat dinyatakan dengan notasi yang ditulis dalam bentuk:
Zn(s) | Zn2+(aq) || Cu2+(aq) | Cu(s)
Notasi tersebut dinamakan notasi sel volta.
Notasi sel volta digunakan untuk menggambarkan rangkaian sel volta dan reaksi redoks yang berlangsung didalamnya. Secara umum, penulisan notasi sel volta menurut konvensi IUPAC adalah sebagai berikut.
- Notasi sel terdiri dari anode dan katode
- Tanda || adalah jembatan garam untuk memisahkan fase berbeda.
- Tanda | adalah batas fase untuk memisahkan fase berbeda.
- Tanda koma (,) digunakan untuk memisahkan spesi-spesi dalam fase yang sama.
- Elektrode anode terletak paling kiri dan elektrode katode paling kanan.
- Elektrolit inert tidak ditulis
Untuk lebih jelasnya, simak penulisan beberapa notasi sel volta berikut.
Baca Juga :
Elektrolisis Beserta Soal dan Pembahasannya
Cara Penyetaraan Reaksi Redoks dengan Cara Setengah Reaksi atau Ion Elektron
Cara Penyetaraan Reaksi Redoks dengan Cara Bilangan Oksidasi (Biloks)
1. Suatu sel volta terdiri dari anode Zn dan katode Cu. Di anode, Zn teroksidasi menjadi Zn2+dan dikatode, Cu2+ tereduksi menjadi Cu.
Reaksi sel; Zn(s) + Cu2+(aq) → Cu(s) + Zn2+(aq)
Notasi sel volta:
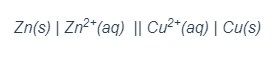
2. Suatu sel volta terdiri dari anode inert Pt dan katode logam Ag. Di anode, H2 teroksidasi menjadi ion H+ dan di katode, Ag+ tereduksi menjadi Ag. (Beberapaa elektrode inert yang digunakan dalam sel volta adalah Platina (Pt), emas (Au), dan grafit (C))
Reaksi sel: H2(g) + 2Ag+(aq) →2H+(aq) + 2Ag(s)
Notasi sel Volta:
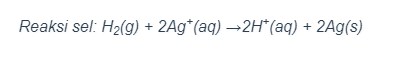
3. Suatu sel volta terdiri dari anode Zn dan katode inert Pt. Di anode, Zn teroksidasi menjadi ion Zn2+ dan di katode, Fe3+ tereduksi menjadi Fe2+.
Reaksi sel: Zn(s) + 2Fe3+(aq) →Zn2+(aq) + 2Fe2+(aq)
Notasi sel Volta:
Supaya lebih faham lagi coba simak contoh solah notasi berikut ini ya.
Contoh soal notasi sel Volta
Tulis notasi sel volta untuk reaksi;
- 2Al(s) + 3Sn2+(aq) → 2Al3+(aq) + 3Sn(s)
- Zn(s) + Cl2(g) → Zn2+(aq) + 2Cl–(aq) (Katode menggunakan elektrode inert Pt)
Jawab:
1. Dari persamaan reaksi, terlihat bahwa di anode, Al(s) teroksidasi menjadi Al3+(aq) dan di katode Sn2+(aq) tereduksi menjadi Sn. Elektrode di anode adalah Al dan elektrode di katode Sn.
Notasi sel volta: Al(s) | Al3+(aq) || Sn2+(aq) | Sn(s)
2.Dari persamaan reaksi, terlihat bahwa di anode, Zn(s) teroksidasi menjadi Zn2+(aq) dan di katode Cl2(g) tereduksi menjadi Cl–(aq). Elektrode di anode adalah Zn dan elektrode di katode adalah Pt.
Notasi sel volta : Zn(s) | Zn2+(aq) || Cl2(g) | Cl–(aq) | Pt(s)
Demikian ulasan mengenai notasi sel volta.. Semoga bermanfaat…..
Artikel Terkait
- Introductions (Perkenalan)
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?