Latihan Soal dan Pembahasan Sistem Periodik Unsur
Disekolah kalau sampai di bab yang cuma materi doang atau hitungannya dikit biasanya murid tuh bakalan dikasih soal seperti ini supaya rangkuman yang kita buat lebih terarah and lebih efisien belajarnya .
So, selamat mencoba metode ini :
1). Sebutkan tiga jenis unsur beserta lambangnya dar unsur-unsur :
a. Tidak bermuatan
b. Bermuatan positive
c. Bermuatan negatif
Kemudian sebutkan masing-masingnya ! No massa , No atom ,No Proton dan No elektron !
Jawaban =
- Unsur
 maka jumlah proton = 19
maka jumlah proton = 19
jumlah elektron = 19
jumlah neutron = 39 – 19 = 20
- unsur
 maka jumlah proton = 17
maka jumlah proton = 17
jumlah elektron = 17 + 1 = 18
jumlah neutron = 35 – 17 = 18
- unsur
 maka jumlah proton = 20
maka jumlah proton = 20
jumlah elektron = 20 – 2 = 18
jumlah neutron = 40 – 20= 20
| Lambang atom / ion | Nomor atom | Nomor massa | Nomor proton | Nomor electron |
 | 19 | 39,102 | 19 | 19 |
 | 17 | 35,453 | 17 | 17 + 1 = 18 |
 | 20 | 40,08 | 20 | 20 – 2 = 18 |
 | 8 | 16 | 8 | 8 |
 | 16 | 32 | 16 | 16 + 2 = 18 |
2). Apa yang dimaksud dengan jari-jari atom , Potensialionisasi , Afinitas elektron , Keelegtonegatifan , Kereaktifan dan sifat logam ?
Jawaban =
- Jari – jari atom merupakan jarak dari inti atom sampai keelektron dikulit terluar . Dalam satu golongan , makin besarnomor atom unsur-unsur golongan makin banyak pula jumlah kulit elektronya sehingga makin besar pula jari-jari atomnya . Dalam satu periode dari kiri kekanan nomor atom bertambah yang berarti makin bertambahnya muatan inti , sedangkan jumlah kulit elektron tetap . Bertambhanya muatan positif yang menarik elektron bermuatan negatif menyebabkan kecilnya jari- jari atom .
- Potensialionisasi adalah energi minimum yang diperlukan atom netral dalam bentuk gas untuk melepaskan suatu elektron membentuk ion bermuatan + 1 . Apabila atom tersebut akan melepaskan elektronya yang kedua maka diperlukan energi yang lebih besar , dan energi tersebut diberi nama ionisasi kedua . Dalam satu periode dari kiri kekanan jari-jari atom makin kecil . Dengan demikian makin kuat daya tarik inti terhadap elektron terluar dan makin sukar elektron tersebut dilepas sehingga energi ionisasi bertambah , Dalam satu olongan dari atas kebawah , nomor atom bertambah karena jumlah kulit bertambah . Akibatnya makin kecil daya tarik inti terhadap elektron terluar , sehingga makin mudah unusr tersebut melepaskan elektron dan makin kecil energi ionisasinya .
- Afinitas elektron adalah energi yang dibebaskan oleh atom netral dalam bentuk gas apabila menerima sebuah elektronuntuk membentuk ion negatif . Makin negatif harga afinitas elektron dalam satu golongan dari atas kebawah , harga afinitras elektron akan bertambah positive .
- Keelegtonegatifan adalah kemampuan suatu usnur untuk menarik elektron dalam molekul senyawa
 | 35 | 80 | 35 | 35 |
 | 11 | 22 | 11 | 11 + 1 = 12 |
 | 12 | 25 | 12 | 12 – 2 = 10 |
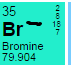 | 35 | 79 | 35 | 79 + 1 = 80 |
Dalam suatu golongan dari atas kebawah jari-jari atom makin besar sehingga harga keelektronegatifanya berkurang . Dalam satu periode untuk unsur dari kiri kekanan jari- jari atom nya makin kecil sehingga harga keelektronegatifan unsur makn besar .
- Kereaktifan adalah suatu bilangan yang menggambarkan kecenderungan relative unsur menarik elektron kepihaknya dalam suatu ikatan kimia . konsepnya =
- Dari atas kebawah dalam satu golongan kelektronegatifan semakin berkurang .
- Dari kiri kekanan dalam satu periode kelektronegatifanya semakin bertambah.
Sifat non logam adalah adalah kelompok unsur kimia yang bersifat elektrnegatif , yaitu lebih mudah menarik elektron valensi dari atom lain dari pada melepaskanya
- Sifat logam akan bergantung pada energi ionisasi . Semakin besar energi ionisasi maka akan semakin sukar atau sulit bagi atom untuk melepas elektron dan semakin berkurang sifat logamnya . Sebaliknya sifat logam dikaitkan dengan keelektronegatifan , yaitu kecenderungan atom menarik elektron . Unsur yang terletak pada bagian tengah , yaitu unsur yang terletak disekitar daerah perbatasan antara logam dan non logam mempunyai sifat logam sekaligus sifat non logam . Unsur itu disebut unsur Metaloid .
sekian yang bisa saya share , semoga bermanfaat ya .
Artikel Terkait
- Atom X Mempunyai 10 Elektron dan 12 Neutron. Nomor Massa Unsur X Itu Adalah... Jawaban dan Pembahasan
- Unsur X Mempunyai 10 Proton dan 12 Neutron, Sedangkan Unsur Y Mempunyai Nomor Massa 23 dan Nomor Atom 11. Kedua Atom Tersebut Merupakan .....
- Jika Suatu Unsur Dilambangkan dengan Satu Huruf Maka Harus Digunakan Huruf...
- Unsur-Unsur Kimia yang Diperlukan Oleh Tanaman Sebagai Nutrient Dinamakan...
- Unsur yang Mengikat Dua Elektron Untuk Mendapatkan Konfigurasi Elektron yang Stabil Adalah ....
- Zat Tunggal yang Tidak Bisa Lagi Disederhanakan Menggunakan Reaksi Kimia Biasa Disebut Dengan...
- Zat Tunggal yang Tersusun dari Beberapa Unsur dengan Perbandingan Massa Tetap Disebut?
- Unsur-unsur Kimia yang Diperlukan Oleh Tanaman Sebagai Nutrient Dinamakan?
- Unsur Kimia dengan Simbol Sn pada Tabel Periodik Adalah?
- Sebutkan Tiga Unsur dalam Wawancara