Kepolaran Senyawa Ion dan Kovalen
Polar sendiri berasal dari kata pole yakni kutub. Kutub disini maksudnya senyawa polar ialah yang memiliki 2 kutub. Kutub apa saja itu dan bagaimana maksudnya?
Kutub pertama kutub negatif dan yang kedua ialah kutub positif. Hal ini terjadi akibat adanya unsur unsur dengan keelektronegatifan yang tinggi dan keelektronegatifan yang rendah dalam 1 senyawa.
Bagi yang belum tahu tentang keelektronegatifan, akan saya jelaskan terlebih dahulu. kalau yang sudah, bisa langsung melangkah sedikit kebawah. Elektronegatif ialah sifat suatu unsur yang suka/cenderung menarik elektron dari atom lain. semakin tinggi sifat elektronegatifnya maka akan semakin kuat tarikannya terhadap elektron lain.
1. Senyawa Kovalen Polar
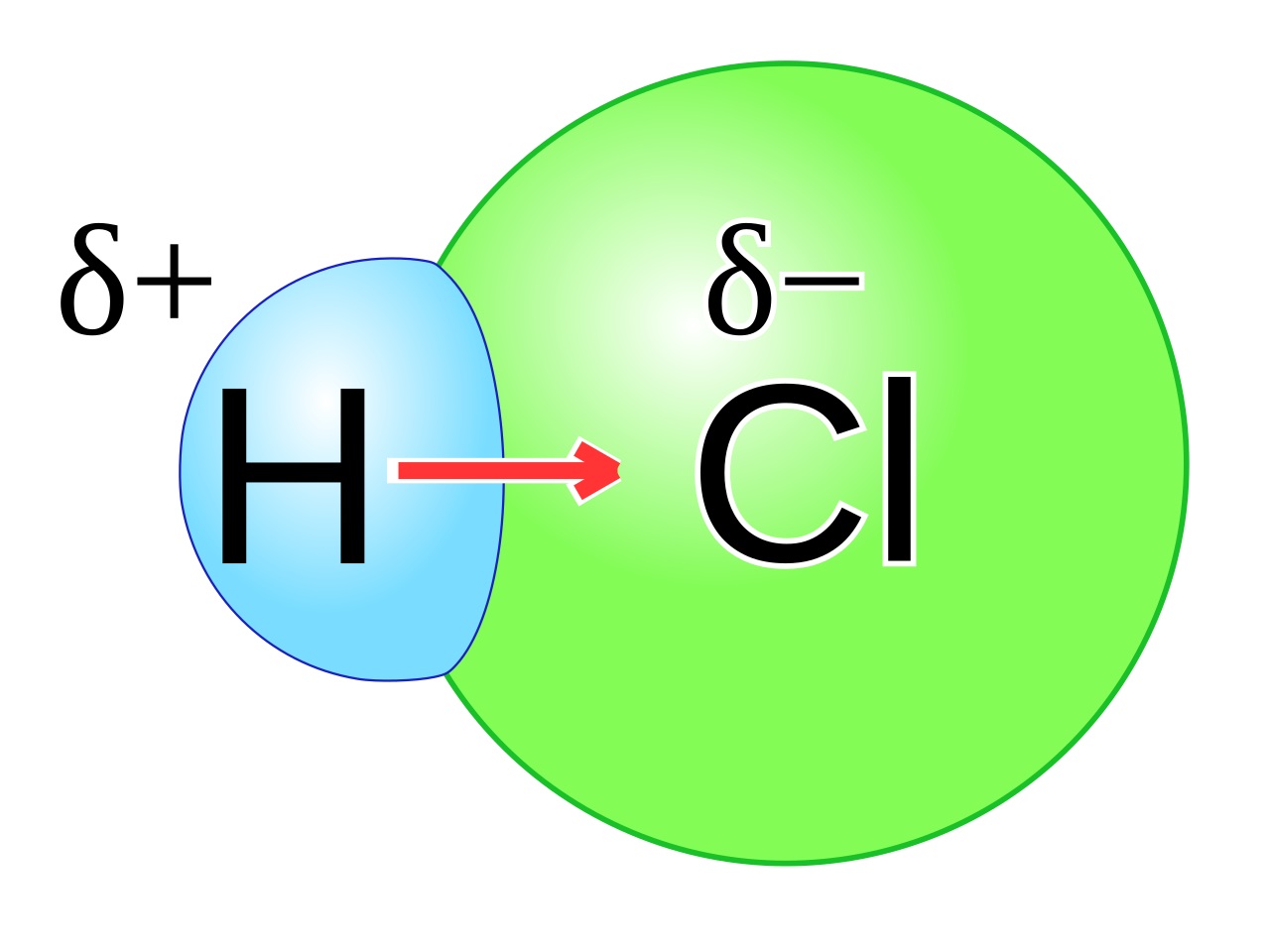
Pada tabel periodik, semakin ke kanan maka unsur akan memiliki nilai keelektronegatifan lebih tinggi kecuali pada gas mulia. Gas mulia tidak termasuk yang elektronegatif karena gas mulia telah stabil. Misalnya saja atom H dan atom Cl. tentu saja Cl lebih elektronegatif daripada H.
Selanjutnya, Jika atom atom seperti H dan O tersebut membentuk senyawa dengan pola tertentu maka akan terbentuklah senyawa polar. Senyawa kovalen dikatakan polar jika senyawa tersebut memiliki perbedaan keelektronegatifan. Dengan demikian, pada senyawa yang berikatan kovalen terjadi pengutuban muatan. Ikatan kovalen tersebut dinamakan ikatan kovalen polar.
Contoh:
H +- O -+ H
H—–O—–H tarikan elektronnya bergerak ke dari H ke O
Maka O menjadi kutub negatif karena memiliki banyak elektron, H akan menjadi kutub positifnya.
2. Senyawa Kovalen Nonpolar
Sebaliknya Senyawa non polar terdiri dari beberapa atom yang memiliki keelektronegatifan yang hampir sama, misalnya saja H dan C. Jika dua atom nonlogam sejenis (diatomik) membentuk suatu senyawa kovalen, misalkan H2, N2, Br2, dan I2 maka ikatan kovalen yang terbentuk memiliki keelektronegatifan yang sama atau tidak memiliki perbedaan keelektronegatifan. Ikatan kovalen tersebut dinamakan ikatan kovalen nonpolar.
Contoh:
CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH=O
Begitu pula senyawa yang memiliki simetri tertentu, walaupun memliki penyusun yang elektronegatif dan tidak akan menjadi polar. Misalnya CCl4 Karena sudut antara Cl semetri maka tarikan antar Cl akan meniadakan satu sama lainnya.
Demikian artikel ini, jika ada yang kurang jelas silahkan bertanya. semoga bermanfaat.