Kalorimeter Sederhana dan Kalorimeter Bom
Kalorimeter adalah alat untuk perubahan entalpi. Kalorimeter yang biasa digunakan adalah kalorimeter sederhana dan kalorimeter bom. Berikut penjelasan selengkapnya.
KALORIMETER
Perubahan entalpi dapat diukur menggunakan kalorimeter sederhana dan kalorimeter bom.
1. KALORIMETER SEDERHANA
Kalorimeter sederhana dapat diibuat dari gelas atau wadah yang bersifat isolator, misalnya gelas styrofoam atau plastik yang bersifat isolator. Dengan demikian, selama reaksi berlangsung dianggap tidak ada kalor yang diserap maupun dilepaskan oleh sistem ke lingkungan, sehingga:
qreaksi + qkalorimetr + qlaruatan = qsistem
qreaksi + qkalorimetr + qlaruatan = 0
atau
qreaksi = -(qkalorimeter + qlarutan)
Jika nilai kapasitas kalor kalorimeter sangat kecil, kalor kalorimetr dapat diabaikan sehingga perubahan kalor dapat dianggap hanya berakibat pada kenaikan suhu larutan dalam kalorimetr.
qreaksi = -qlarutan
qlarutan = m x c x ∆T
dengan q = kalor reaksi ( J atau kJ )
m = massa ( g atau kg )
c = kalor jenis ( J/goC atau J/kg K)
∆T = perubahan suhu ( oC atau K )
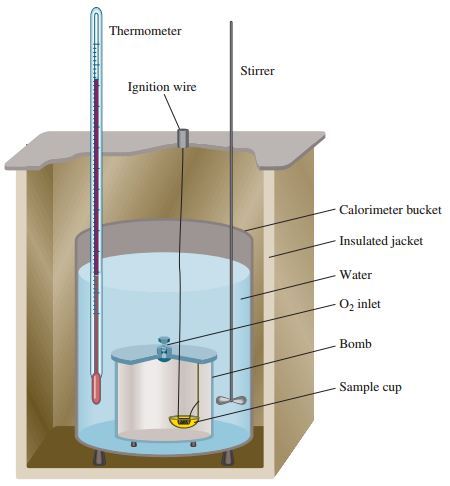
2. KALORIMETER BOM
Alat yang lebih teliti untuk mengukur perubahan kalor adalah kalorimeter bom , yaitu suatu kalorimeter yang dirancang khusus sehingga sistem benar – benar dalam keadaan terisolasi . Umumnya digunakan untuk menentukan perubahan entalpi dari reaksi – reaksi pembakaran yang melibatkan gas . Di dalam kalorimeter bom terdapat ruang khusus tempat berlangsungnya reaksi yang di sekitarnya diselubungi air sebagai penyerap kalor .
Sistem reaksi di dalam kalorimeter dilakukan benar – benar terisolasi sehingga kenaikan atau penurunan suhu yang terjadi benar – benar hanya digunakan untuk menaikan suhu air di dalam kalorimeter bom . Meskipun sistem telah diusahakan terisolasi tetapi ada kemungkinan sistem masih dapat menyerap atau melepaskan kalor ke lingkungan, yang dalam hal ini lingkungannya adalah kalorimeter itu sendiri. Jika kalorimeter juga terlibat di dalam di dalam pertukaran kalor , besarnya kalor yang diserap atau dilepas oleh kalorimeter harus diperhitungkan. Kalor yang dilepas atau diserap oleh kalorimetr disebut dengan kapasitas kalor kalorimeter ( Ckalorimeter ). Secara keseluruhan dirumuskan:
qreaksi + qkalorimetr + qair = qsistem
qreaksi + qkalorimetr + qair = 0
atau
qreaksi = -( qkalorimeter + qair )
qkalorimeter = Ckalorimetr x ∆T
dengan Ckalorimetr = kapasitas kalor kalorimeter ( JoC-1 atau JK-1 )
∆T = perubahan suhu ( oC atau K )
Contoh soal kalorimeter
1. Di dalam suatu kalorimetr bom direaksikan 0,16 gram gas metana (CH4) dengan oksigen berlebihan, sehingga terjadi reaksi :
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
Ternyata terjadi kenaikan suhu 1,56oC. Diketahui kapasitas kalor kalorimetr adalah 958 J/oC, massa air di dalam kalorimetr adalah 1.000 gram dan kalor jenis air 4,18 J/goC. Tentukanlah kalor pembakaran gas metana dalam kJ/mol. ( Ar C = 12, H = 1 )
Jawab :
Kalor yang dilepas selama reaksi sama denga kalor yang diserap oleh air dalam kalorimetr dan oleh kalorimetr , maka :
qreaksi = -( qkalorimetr + qair )
qair = mair x cair x ∆T = 958 J/oC x 1,56 oC = 6.520 J
qkalorimetr = Ckalorimetr x ∆T = 958 J/oC x 1,56oC = 1.494 J
maka :
qreaksi = -(6.520 + 1.494) J = -8.014 J = -8,014 kJ
Jumlah metana yang dibakar adalah 00,16 gram sehingga jumlah molnya adalah
Mol CH4 = 0,16 g / 16 g/mol = 0,01 mol
Maka, untuk setiap reaksi pembakaran satu mol CH4 akan dilepaskan kalor sebanyak:
qreaksi = -8,014 kJ / 0,01 mol = -801,4 kJ/mol
Oleh karena reaksi pada kalorimetr bom dilakukan pada volume tetap, besarnya ∆H = qreaksi = -801,4 kJ/mol
Artikel Terkait
- Introductions (Perkenalan)
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?