KOVALEN POLAR
Ikatan kovalen polar terjadi karena adanya dua kutub (dipol). Contoh senyawa kovalen polar adalah NH3,PCl3, H2O, dan Cl2O. Mari kita simak selengkapnya berikut ini.
Ikatan kovalen dapat berupa kovalen polar dan ikatan kovalen nonpolar. Sifat kepolaran ikatan ini dipengaruhioleh perbedaan keelektronegatifan, sedangkan bentuk molekul dari atom-atom yang berikatan akan menentukan sifat kepolaran molekulnya.
1. Pengaruh Perbedaan Keelektronegatifan terhadap Kepolaran Ikatan Kovalen
Jika suatu ikatan kovalen terbentuk dari dua buah atom nonlogam yang memiliki perbedaan keelektronegatifan yang besar, pasangan elektron akan lebih tertarik ke arah atom yang memiliki keelektronegatifan lebih besar. Akibatnya, atom yang lebih elektronegatif cenderung memiliki kelebihan muatan negatif (δ–), sedangkan atom yang kurang elektronegatif memiliki kelebihan muatan positif (δ+). Adanya dua kutub yang bermuatan berlawanan tersebut menyebabkan terbentuknya suatu dipol. Semakin besar perbedaan keelektronegatifan atom-atom dalam suatu molekul, menyebabkan ikatan dalam molekul tersebut bersifat semakin polar.

Dalam molekul HCl, pasangan elektron yang membentuk ikatan kovalen anata atom H dengan atom Cl lebih tertarik ke arah atom Cl. Ikatan ini disebut sebagai ikatan kovalen polar. Ikatan kovalen polar terbentuk jika atom-atom yang berikatan memiliki perbedaan keelektronegatifan. Perbedaan ini menyebabkan pemisahan muatan pada atom-atom yang berikatan. Dengan demikian, pada molekul-molekul senyawa kovalen polar terbentuk kutub bermuatan positif dan kutub bermuatan negatif. Dengan kata lain, terbentuk dua kutub (dipol) dalam molekul-molekul yaang bersifat polar.
Pada molekul HCl, keelektronegatifan H = 2,1 dan Cl = 3,0 sehingga terjadi perbedaan keelektronegatifan yang besar. Akibat perbedaan keelektronegatifan tersebut, dalam molekul HCl timbul kutub positif pada atom H dan kutub negatif pada atom Cl. Dapat juga dikatakan bahwa atom H cenderung bermuatan positif (δ+) dan atom cl cenderung bermuatan negatif (δ–).
Beberapa contoh senyawa dengan perbedaan keelektronegatifan besar dapat sobat lihat di bawah
| Senyawa | Perbedaan Keelektronegatifan |
| HF | 1,9 (H=2,1; F=4,0) |
| HCl | 0,9 (H=2,1; Cl=3,0) |
| HBr | 0,7 (H=2,1; Br=2,8) |
| HI | 0,4 (H=2,1; I=2,5) |
Jika atom-atom nonlogam berikatan dengan sesamanya dan membentuk molekul diatomik, ikatan yang terbentuk tidak memiliki perbedaan keelektronegatifan (perbedaan keelektronegatifan = 0). Dengan demikian, tidak terbentuk muatan ataupun dipol. Pada molekul Cl2, pasangan elektron yang membentuk ikatan kovalen antaratom Cl tertarik sama kuat ke kedua atom. Hal ini disebabkan keelektronegatifan kedua atomsama besar. Distribusi muatan yang sama ini menyebabkan molekul Cl2 tidak membentuk kutub-kutub. Ikatan ini disebut ikatan kovalen nonpolar. Contoh senyawa yang memiliki ikatan kovalen nonpolar adalah H2, N2, O2, I2 dan Br2.
2. Pengaruh Bentuk Molekul terhadap Kepolaran Molekul
Ikatan yang terbentuk antara atom C dan atom Cl memiliki perbedaan keelektronegatifan sebesar 0,4. Berarti, ikatan kovalen ini bersifat polar. Namun, jika atom C mengikat empat buah atom Cl dan membentuk molekul CCl4, lain cerita, molekulnya bersifat nonpolar. Mengapa?

Pada molekul CCl4, atom pusat C berada di tengah dan secara simetris mengikat keempat atom Cl. Hal tersebut meyebabkan tidak ada pemisahan muatan sehingga dipol tidak terbentuk. Jadi, walaupun ikatannya bersifat polar, molekulnya bersifat nonpolar. Contoh senyawa lain yang memiliki bentuk molekul simetris dan bersifat nonpolar adalah CH4, BH3, BCl3, PCl5, dan CO2.
Senyawa akan bersifat polar jika pada atom pusat dari molekul tersebut terdapat pasangan elektron bebas sehingga bentuk molekulnya menjadi tidak simetris.
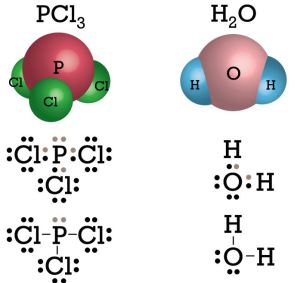
Senyawa apa sajakah yang bersifat polar? Contoh senyawa kovalen polar adalah NH3,PCl3, H2O, dan Cl2O. Perhatikan struktur Lewis untuk senyawa PCl3 dan H2O berikut.

Pada senyawa PCl3 terdapat sebuah PEB, dan pada senyawa H2O terdapat dua buah PEB sehingga kedua molekul tersebut menjadi tidak simetris dan bersifat polar.
Molekul CH4 dan CCl4 memiliki bentuk simetris. Bagaimana dengan senyawa CHCl3? Jika sebuah atom Cl pada senyawa CCl4 digantikan oleh atom H, senyawa CHCl3 yang terbentuk menjadi tidak simetris sehingga bersifat polar.
Selain berdasarkan perbedaan keelektronegatifan dan bentuk molekul, sobat dapat mengetahui kepolaran suatu senyawa berdasarka percobaan.
Demikianlah tulisan mengenai ikatan kovalen polar. Semoga bermanfaat …..
Artikel Terkait
- Introductions (Perkenalan)
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?