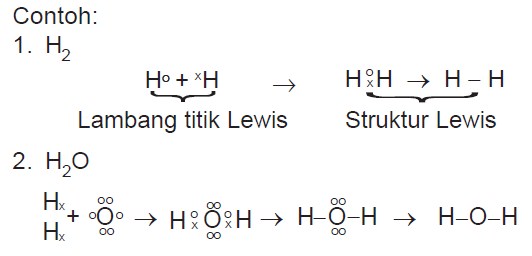Ikatan Kimia Beserta Pengertian dan Jenis Ikatan Serta Contohnya
Selain gas mulia di alam unsur-unsur tidak selalu berada sebagai unsur bebas (sebagai atom tunggal), tetapi kebanyakan bergabung atau berikatan dengan atom unsur lain. Tahun 1916 G.N. Lewis dan W. Kossel menjelaskan hubungan kestabilan gas mulia dengan konfigurasi elektron. Kecuali He; mempunyai 2 elektron valensi; unsur-unsur gas mulia mempunyai 8 elektron valensi sehingga gas mulia bersifat stabil. Atom-atom unsur cenderung mengikuti gas mulia untuk mencapai kestabilan. Jika atom berusaha memiliki 8 elektron valensi, atom disebut mengikuti aturan oktet. Unsur-unsur dengan nomor atom kecil (seperti H dan Li) berusaha mempunyai elektron valensi 2 seperti He disebut mengikuti aturan duplet.
Ikatan Kimia
Dalam ikatan kimia, cara yang diambil unsur supaya dapat mengikuti gas mulia, yaitu:
- melepas atau menerima elektron;
- pemakaian bersama pasangan elektron.
Ikatan kimia yang akan dibahas kali ini terdapat tiga jenis ikatan yaitu ikatan ion, ikatan kovalen, dan ikatan logam. Sebelum memahami ketiga janis ikatan tersebut, terlebih dahulu sahabat harus memahami arti dari ikatan kimia itu sendiri.
Pengertian Ikatan Kimia
Ikatan Kimia adalah interaksi yang menjelasakan hubungan antar atom sehingga menjadi molekul ion, kristal, dan spesies yang stabil lainnya.
1) Ikatan Ion
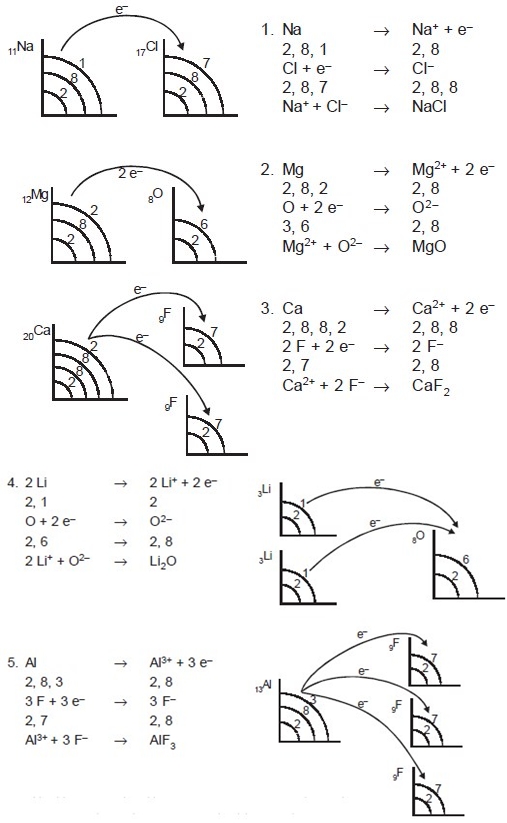
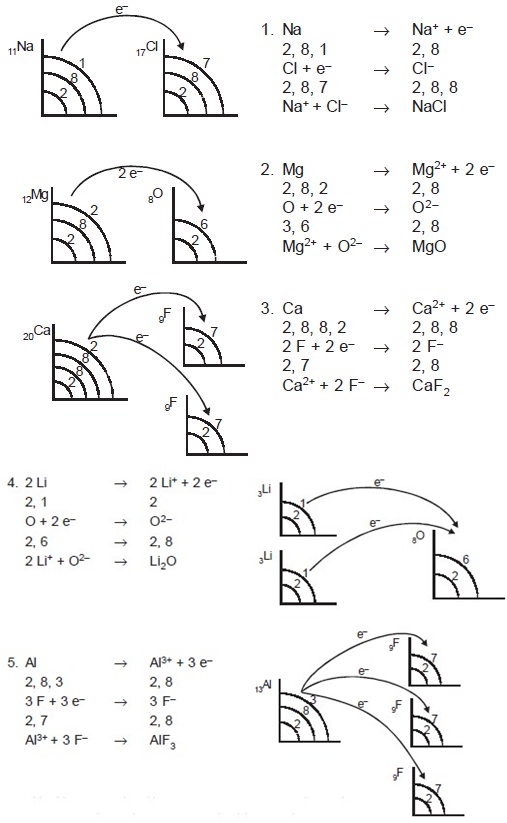
Ikatan ion terbentuk akibat adanya melepas atau menerima elektron oleh atom-atom yang berikatan. Atom-atom yang melepas elektron menjadi ion positif (kation) sedang atom-atom yang menerima elektron menjadi ion negatif (anion). Ikatan ion biasanya disebut ikatan elektrovalen. Senyawa yang memiliki ikatan ion disebut senyawa ionik. Senyawa ionik biasanya terbentuk antara atom-atom unsur logam dan nonlogam. Atom unsur logam cenderung melepas elektron membentuk ion positif, dan atom unsur nonlogam cenderung menangkap elektron membentuk ion negatif. Contoh: NaCl, MgO, CaF2, Li2O, AlF3, dan lain-lain.
 |
| Gambaran Ikatan Kimia Khusus Ikatan Ion |
Lambang titik elektron Lewis terdiri atas lambang unsur dan titik-titik yang setiap titiknya menggambarkan satu elektron valensi dari atom-atom unsur. Titik-titik elektron adalah elektron terluarnya.
Tabel contoh-contoh lambang titik elektron lewis
Untuk membedakan asal elektron valensi penggunaan tanda (O) boleh diganti dengan tanda (x), tetapi pada dasarnya elektron mempunyai lambang titik Lewis yang mirip. Lambang titik Lewis untuk logam transisi, lantanida, dan aktinida tidak dapat dituliskan secara sederhana, karena mempunyai kulit dalam yang tidak terisi penuh. Contoh penggunaan lambang titik Lewis dalam ikatan ion sebagai berikut.
Sifat-sifat fisika senyawa ionik pada umumnya:
- Pada suhu kamar berwujud padat;
- Struktur kristalnya keras tapi rapuh;
- Mempunyai titik didih dan titik leleh tinggi;
- Larut dalam pelarut air tetapi tidak larut dalam pelarut organik;
- Tidak menghantarkan listrik pada fase padat, tetapi pada fase cair (lelehan) dan larutannya menghantarkan listrik.
2) Ikatan Kovalen
Ikatan kovalen terjadi karena pemakaian bersama pasangan elektron oleh atom-atom yang berikatan. Pasangan elektron yang dipakai bersama disebut pasangan elektron ikatan (PEI) dan pasangan elektron valensi yang tidak terlibat dalam pembentukan ikatan kovalen disebut pasangan elektron bebas (PEB). Ikatan kovalen umumnya terjadi antara atom-atom unsur nonlogam, bisa sejenis (contoh: H2, N2, O2, Cl2, F2, Br2, I2) dan berbeda jenis (contoh: H2O, CO2, dan lain-lain). Senyawa yang hanya mengandung ikatan kovalen disebut senyawa kovalen.
Berdasarkan lambang titik Lewis dapat dibuat struktur Lewis atau rumus Lewis. Struktur Lewis adalah penggambaran ikatan kovalen yang menggunakan lambang titik Lewis di mana PEI dinyatakan dengan satu garis atau sepasang titik yang diletakkan di antara kedua atom dan PEBdinyatakan dengan titik-titik pada masing-masing atom.
Macam-macam ikatan kovalen:
1. Berdasarkan jumlah PEI-nya ikatan kovalen dibagi 3:
- Ikatan kovalen tunggal
Ikatan kovalen tunggal yaitu ikatan kovalen yang memiliki 1 pasang PEI.
Contoh: H2, H2O (konfigurasi elektron H = 1; O = 2, 6)
- Ikatan kovalen rangkap dua
Ikatan kovalen rangkap 2 yaitu ikatan kovalen yang memiliki 2 pasang PEI.
Contoh: O2, CO2 (konfigurasi elektron O = 2, 6; C = 2, 4)
- Ikatan kovalen rangkap tiga
Ikatan kovalen rangkap 3 yaitu ikatan kovalen yang memiliki 3 pasang PEI.
Contoh: N2 (Konfigurasi elektron N = 2, 5)
2. Berdasarkan kepolaran ikatan, ikatan kovalen dibagi 2:
- Ikatan kovalen polar
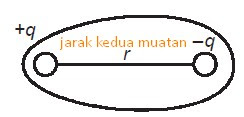
Ikatan kovalen polar adalah ikatan kovalen yang PEInya cenderung tertarik ke salah satu atom yang berikatan. Kepolaran suatu ikatan kovalen ditentukan oleh keelektronegatifan suatu unsur. Senyawa kovalen polar biasanya terjadi antara atom-atom unsur yang beda keelektronegatifannya besar, mempunyai bentuk molekul asimetris, mempunyai momen dipol [μ = hasil kali jumlah muatan (q) dengan jaraknya (r)] ≠ 0.
Contoh:
1) HF
H – F
Keelektronegatifan 2,1; 4,0
Beda keelektronegatifan = 4,0 – 2,1 = 1,9
μ = q x r = 1,91 Debye
- Ikatan kovalen nonpolar
Ikatan kovalen nonpolar yaitu ikatan kovalen yang PEInya tertarik sama kuat ke arah atom-atom yang berikatan. Senyawa kovalen nonpolar terbentuk antara atom-atom unsur yang mempunyai beda keelektronegatifan nol atau mempunyai momen dipol = 0 (nol) atau mempunyai bentuk molekul simetri.
3. Ikatan kovalen koordinasi
Ikatan kovalen koordinasi adalah ikatan kovalen yang PEInya berasal dari salah satu atom yang berikatan.
Contoh:
NH4+
NH3 + H+ → NH4+
Sifat-sifat fisis senyawa kovalen:
- Pada suhu kamar berwujud gas, cair (Br2), dan ada yang padat (I2);
- Padatannya lunak dan tidak rapuh;
- Mempunyai titik didih dan titik leleh rendah;
- Larut dalam pelarut organik tapi tidak larut dalam air;
- Umumnya tidak menghantarkan listrik.
3) Ikatan Logam
Ikatan logam adalah ikatan kimia yang terbentuk akibat penggunaan bersama elektron-elektron valensi antaratomatom logam. Contoh: logam besi, seng, dan perak. Ikatan logam bukanlah ikatan ion atau ikatan kovalen. Salah satu teori yang dikemukakan untuk menjelaskan ikatan logam adalah teori lautan elektron.
Contoh terjadinya ikatan logam. Tempat kedudukan elektron valensi dari suatu atom besi (Fe) dapat saling tumpang tindih dengan tempat kedudukan elektron valensi dari atom-atom Fe yang lain. Tumpang tindih antarelektron valensi ini memungkinkan elektron valensi dari setiap atom Fe bergerak bebas dalam ruang di antara ion-ion Fe+ membentuk lautan elektron. Karena muatannya berlawanan (Fe2+ dan 2 e–), maka terjadi gaya tarik-menarik antara ion-ion Fe+ dan elektron-elektron bebas ini. Akibatnya terbentuk ikatan yang disebut ikatan logam.
Adanya ikatan logam menyebabkan logam bersifat:
- Pada suhu kamar berwujud padat, kecuali Hg;
- Keras tapi lentur/dapat ditempa;
- Mempunyai titik didih dan titik leleh yang tinggi;
- Penghantar listrik dan panas yang baik;
- Mengilap.
Demikian penjelasan mengenai Ikatan Kimia dan beberapa penjelasan yang berkaitan dengan ikatan kimia tersebut. Semoga dapat dengan mudah dipelajari dan dipahami. Ucapan terima kasih kami haturkan karena perkenaan sahabat untuk membaca materi Kimia yang sempat kami bagikan kali ini.
Artikel Terkait
- Introductions (Perkenalan)
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?