FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI
Faktor yang dapat mempengaruhi laju reaksi ada 5 yaitu luas permukaan sentuhan antara zat-zat yang bereaksi, sifat kimia pereaksi, konsentrasi, suhu, dan katalis.
1. Luas Permukaan
Luas permukaan sentuhan antara zat-zat yang bereaksi merupakan suatu faktor yang mempengaruhi laju reaksi bagi campuran pereaksi yang heterogen, misalnya antara zat padat dan gas, zat padat dengan larutan, dan dua macam zat cair yang tak dapat campur. Reaksi kimia dapat berlangsung jika molekul-molekul, atom-atom, atau ion-ion dan zat-zat pereaksi terlebih dahulu bertumbukan. Hal ini terjadi jika antara zat-zat yang akan bereaksi terjadi kontak.
Semakin luas permukaan sentuhan antara zat-zat yang bereaksi, semakin banyak molekul-molekul yang bertumbukan dan semakin cepat reaksinya.
Pada reaksi antara zat padat dan gas atau antara zat padat dan larutan, kontak terjadi di permukaan zat padat itu. Adapun kontak yang terjadi antara dua zat cair yang tidak dapat bercampur terjadi pada bidang batas antara kedua macam zat cair tersebut.
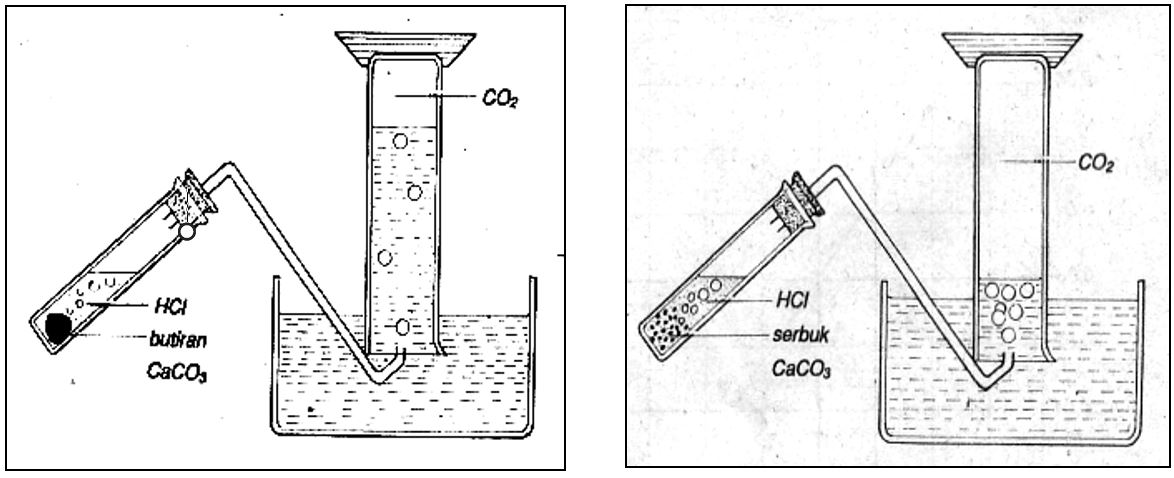
Contoh: Reaksi antara pualam (CaCO3) dengan HCl
Untuk membuktikan pengaruh luas permukaan sentuhan antara zat-zat yang bereaksi terhadap laju reaksinya, dapat diambil contoh reaksi antara pualam dan larutan HCI yang berlangsung menurut persamaan sebagai berikut.
CaCO3(S) + 2HCI(aq) → CaCI2(aq) + H2O(l) + CO2(aq)
Pada percobaan pertama digunakan CaCO3 berbentuk butiran dan pada percobaan kedua digunakan CaCO3 berupa serbuk. Harus diperhatikan bahwa pada kedua percobaan itu massa CaCO3 dan konsentrasi larutan HCI yang digunakan harus sama.
Perbedaan laju reaksi tersebut dapat diketahui dengan membandingkan volum gas CO2 yang terbentuk selama selang waktu tertentu yang sama. Ternyata volume CO2 yang dihasilkan pada percobaan pertama lebih sedikit daripada yang diperoleh pada percobaan kedua. Hal ini membuktikan bahwa laju reaksi yang menggunakan serbuk CaCO3 lebih besar daripada yang menggunakan butiran CaCO3.
Perhatikan sebutir CaCO3 yang berbentuk kubus seperti terlihat pada Gambar di bawah. Apabila panjang tiap-tiap rusuk 2 sentimeter, maka luas permukaan kubus itu adalah (6 x 4) cm2 = 24 cm2. Permukaan seluas itulah daerah persentuhan antara CaCO3 dan larutan HCI jika butiran itu dimasukkan seluruhnya ke dalam larutan HCI. Apabila butiran CaCO3 di atas dibagi menjadi 8 buah kubus kecil yang sama ukurannya, maka luas permukaan kedelapan kubus itu adalah (8 x 6 x 1) cm2 = 48 cm2. Selanjutnya, jika tiap-tiap kubus kecil itu dibagi menjadi 8 bagian lagi, maka luas permukaannya menjadi (8 x 2 x 48) cm2 = 768 cm2.
Mudah dibayangkan bahwa makin diperkecil butiran CaCO3 itu, makin luas jumlah seluruh permukaannya. Itulah sebabnya, serbuk CaCO3 bereaksi lebih cepat dari pada CaCO3 berbentuk butiran.
Perbandingan luas permukaan
Dalam sistem homogen tidak terdapat bidang batas antara zat-zat yang bereaksi. Persentuhan antara partikel-partikel zat yang bereaksi terjadi secara merata dalam fase cair atau gas. Oleh karena itu, dalam sistem homogen tidak ada pengaruh faktor luas permukaan terhadap laju reaksinya
2. Sifat Kimia Pereaksi
Apabila sekeping logam natrium dimasukkan kedalam air, segera terjadi reaksi yang hebat. Reaksi antara logam natrium dan air berlangsung sangat cepat disertai ledakan dan nyala berwama kuning. Lain halnya jika logam magnesium yang dimasukkan ke dalam air. Gelembung-gelembung gas hidrogen yang terjadi dalam reaksi antara logam magnesium dan air itu hampir tidak terlihat karena reaksinya berlangsung lambat. Perbedaan laju reaksi antara air dan kedua jenis logam itu disebabkan oleh perbedaan kemampuan melepaskan elektron dari tiap-tiap jenis atom logam. Atom natrium lebih mudah memberikan elektronnya kepada air daripada atom magnesium.
Perbedaan jenis ikatan kimia yang ada pada berbagai macam senyawa juga menentukan perbedaan laju reaksi yang terjadi jika senyawa-senyawa itu bereaksi. Pada umumnya senyawa-senyawa ion bereaksi lebih cepat daripada senyawa-senyawa kovalen. Misalnya, reaksi antara larutan AgNO3 dan larutan HCl berlangsung lebih cepat daripada reaksi antara larutan Na2S2O3 dan larutan HCI. Pada reaksi antara larutan AgNO3 dan larutan HCI, ion-ion Ag+ dan Cl– segera saling berikatan membentuk endapan putih AgCI. Hal ini karena antara ion-ion yang berlawanan muatan itu terdapat gaya tarik-menarik listrik yang membantu terjadinya tumbukan. Pada reaksi antara larutan Na2S2O3 dan larutan HCl, terjadinya endapan putih dan belerang berlangsung lambat. Reaksi antara ion H+ dan S2O32- menjadi H2S2O3 berlangsung cepat, tetapi endapan yang terjadi tidak dihasilkan dari reaksi antara ion-ion itu. Endapan belerang tenjadi karena reaksi pemutusan ikatan kovalen dalam molekul H2S2O3 yang berlangsung labat.
Ag+(aq) + Cl–(aq) → AgCI(s) (cepat)
2H+(aq) + S2O32-(aq) → H2S2O3(aq) (cepat)
H2S2O3(aq) → H2O(l) + SO2(g) + S(s) (lambat)
Reaksi senyawa-senyawa kovalen berlangsung lebih lambat daripada senyawa-senyawa ion karena pada senyawa kovalen tidak terdapat gaya tarik-menarik listrik antara partikel-partikelnya. Selain itu, juga diperlukan sejumlah energi untuk memutuskan ikatan kovalen dan senyawa yang bereaksi tersebut.
Dari kedua contoh di atas, dapat disimpulkan bahwa sifat-sifat kimia seperti, perbedaan keelektronegatifan dan perbedaan jenis ikatan kimia dari zat-zat yang bereaksi turut menentukan laju reaksi yang terjadi. Reaksi antara zat-zat yang perbedaan keelektronegatifannya besar, biasanya berlangsung lebih cepat daripada reaksi antara zat-zat yang memiliki perbedaan keelektronegatiIan lebih kecil.
3. Konsentrasi
Laju reaksi dipengaruhi oleh konsentrasi zat-zat yang bereaksi, meskipun pengaruh itu tidak selalu sama untuk setiap zat dan untuk setiap reaksi. Pada umumnya, kenaikan konsentrasi akan menaikkan laju reaksi, misalnya reaksi antara CaCO3 dan larutan HCI.
CaCO3(s) + 2HCl(l) → CaCI2(aq) + H2O(aq) + CO2(g)
Laju reaksi tersebut akan menjadi dua kali lebih besar jika konsentrasi larutan HCI dijadikan dua kali semula. Akan tetapi, dalam reaksi antara larutan Na2S2O3 dan larutan HCI, perubahan konsentrasi HCl tidak mempengaruhi laju reaksi. Pada reaksi itu, laju reaksi tersebut hanya dipengaruhi oleh konsentrasi larutan Na2S2O3.
Bertambahnya laju reaksi karena pembesaran konsentrasi zat-zat yang bereaksi dapat dipahami karena semakin besarnya konsentrasi dan kemungkinan terjadinya tumbukan antara partikel-partikel zat yang bereaksi semakin besar. Akan tetapi, tidak selalu setiap tumbukan akan menjamin berlangsungnya reaksi. Oleh karena itu, penjelasan tentang laju reaksi tidak sesederhana itu.
4. Suhu
Zat-zat akan saling bereaksi jika masing-masing mempunyai energi yang cukup. Apabila arang dibiarkan di udara pada suhu kamar, arang tidak akan terbakar. Demikian pula minyak tanah, bensin, kertas, atau kayu tidak akan terbakar atau bereaksi dengan oksigen di udara tanpa dibakar terlebih dahulu. Tampaknya ada suatu penghalang untuk terjadinya reaksi. Penghalang itu dapat diatasi dengan menaikkan suhu pereaksi, misalnya dengan menyulut bahan-bahan itu. Menyulut arang kayu, berarti memberikan energi yang cukup pada oksigen dan arang kayu untuk mengatasi penghalang tersebut. Setelah reaksi berlangsung, kalor yang dibebaskan membantu reaksi untuk mengatasi penghalang tersebut sehingga terus berjalan.
Kadang-kadang reaksi kimia dapat berlangsung tanpa menaikkan suhu pereaksi terlebih dahulu. Hal ini mungkin disebabkan campuran reaksi itu telah memiliki energi yang cukup untuk mengatasi penghalang pada suhu rendah atau zat-zat itu memiliki kemampuan untuk mengatasi hambatan itu. Meskipun demikian, reaksi akan berlangsung lebih cepat jika diberikan energi dari luar dengan menaikkan suhu. Hal ini disebabkan semakin tinggi suhu, kecepatan gerak partikel semakin bertambah sehingga tumbukan-tumbukan yang terjadi lebih efektif untuk menghasilkan reaksi. Pada umumnya laju reaksi bertambah menjadi dua kali setiap kenaikan suhu 10°C.
Untuk mengetahui pengaruh perubahan suhu terhadap laju reaksi, dapat dilakukan kegiatan sebagai berikut.
Buat tanda silang yang sama tebalnya pada dua helai kertas kecil dan tempelkan kertas itu pada dua gelas kimia dengan tanda silang menghadap ke dalam. Masukkan 100 mililiter larutan Na2S2O3 0,1 M ke dalam gelas kimia I, ukur suhunya dan catat. Tambahkan 10 mililiter larutan HCI 3 M. Catat waktu sejak penambahan itu sampai tanda silang tepat tidak terlihat lagi. Catat suhu dan waktu selama berlangsungnya reaksi.
Masukkan 100 muliliter larutan Na2S2O3 0,1 M ke dalam gelas kimia Il dan panaskan hingga 10°C di atas suhu kamar, catat suhu itu. Tambahkan 10 mlliliter larutan HCI 3 M dan catat waktu seperti di atas. Catat suhu dan waktu selama berlangsungnya reaksi. Bagaimana pengaruh perubahan suhu terhadap laju reaksi pada larutan Na2S2O3 dengan HCI?
5. Katalis
Pada beberapa peristiwa kimia yang terjadi dalam kehidupan sehari-hari, sering dijumpai zat-zat yang dapat mempercepat terjadinya reaksi. Akan tetapi tampaknya zat itu sendiri tidak ikut bereaksi. Zat ini disebut katalis. Besi yang disimpan di tempat kering tidak cepat berkarat, sedangkan di tempat yang lembap besi akan cepat berkarat. Air yang terdapat di udara lembap mempercepat reaksi antara besi dan oksigen yang ada di udara. Tablet yang mengandung campuran natrium bikarbonat dan asam sitrat dalam keadaan kering tidak akan cepat rusak. Akan tetapi, begitu tablet itu dimasukkan ke dalam air, tablet segera hancur karena natrium bikarbonat dan asam sitrat yang ada di dalamnya bereaksi secara cepat.
Katalis memegang peranan yang sangat penting, baik dalam proses biologi maupun industri. Reaksi-reaksi kimia yang berlangsung di dalam tubuh makhluk hidup akan berjalan sangat lambat jika tanpa katalis. Katalis dalam tubuh makhluk hidup disebut enzim. Hampir semua bahan makanan yang diproses di dalam alat-alat pencernaan merupakan senyawa kovalen (senyawa karbon). CO2 dan H2O yang diproses oleh tumbuhan menjadi karbohidrat melalui fotosintesis juga merupakan senyawa kovalen. Telah dibicarakan pada bagian terdahulu bahwa reaksi-reaksi senyawa kovalen berjalan lambat. Oleh karena itu, enzim sangat diperlukan untuk mempercepat reaksi senyawa-senyawa kovalen. Dalam industri margarin, nikel digunakan sebagai katalis untuk mengubah minyak menjadi lemak buatan. Pembuatan amonia dari hidrogen dan nitrogen melalui proses Haber menggunakan besi sebagai katalis.
N2(g) + 3H2(g) → 2NH3(g)
Katalis dapat dibedakan menjadi dua golongan, yaitu katalis homogen dan katalis heterogen. Katalis homogen adalah katalis yang dapat bercampur dengan pereaksi secara homogen atau mempunyai fase yang sama dengan pereaksi, misalnya campuran gas NO dan NO2 yang bekerja mempercepat reaksi pada proses pembuatan asam sulfat dengan cara Bilik Timbal.
2SO2 + O2 → 2SO3
Contoh lainnya larutan kobalt (II) klorida; CoCl2 atau larutan besi (III) klorida; FeCl3 yang mempercepat reaksi penguraian hydrogen peroksida,
2H2O2 → 2H2O + O2
Katalis heterogen adalah katalis yang mempunyai fase berbeda dengan fase pereaksi, misalnya besi pada reaksi pembuatan amonia melalui proses Haber, batu kawi; MnO2 pada reaksi penguraian kalium klorat; KCIO3, dan vanadiumpentoksida; V2O5 pada reaksi pembuatan asam sulfat melalui proses kontak.
2SO2 + O2 → 2SO3
Selain katalis, ada pula zat-zat yang dapat memperlambat reaksi. Zat itu disebut inhibitor. Penggunaan inhibitor antara lain untuk memperlambat proses perkaratan besi dan untuk menghentikan reaksi-reaksi tertentu dalam proses industri atau reaksi-reaksi tertentu dalam tubuh makhluk hidup. Salah satu contoh inhibitor adalah Na2C2O4 yang dapat menghambat proses perkaratan besi. Dalam tubuh manusia terdapat bermacam-macam hormon yang berfungsi sebagai penghambat reaksi tertentu.
Artikel Terkait
- Introductions (Perkenalan)
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?