MASSA MOLAR
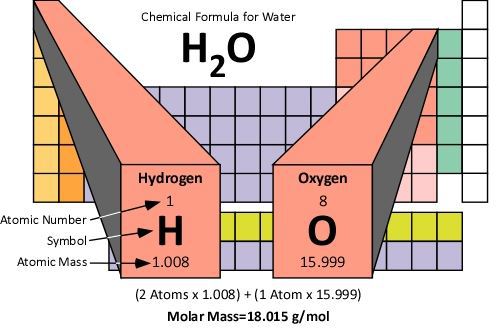
Massa molar adalah massa zat itu yang sama dengan massa atom atau massa rumus zat itu dinyatakan dalam gram. Berikut penjelasan selengkapnya.

massa molar air
Pada pembahasan mol , telah diuraikan hubungan antara massa dengan jumlah partikel dan hubungan antara jumlah partikel dengan satuan mol zat menggunakan tetapan Avogadro. Kedua hubungan tersebut dapat digunakan untuk menyatakan zat dalam satuan gram dan satuan mol, serta dapat digunakan untuk menghubungkan antara satuan gram dan mol dengan menerapkan massa atom relatif atau massa molekul relatif zat itu.
Berdasarkan hubungan antara massa dengan jumlah partikel untuk setiap molnya, terdapat informasi bahwa:
- Dalam 32 gram gas oksigen terkandung 6,02 x 1023 molekul O2
- Dalam 12 gram atom karbon terkandung 6,02 x 1023 atom C
- Dalam 3,999 gram atom helium terkandung 6,02 x 1023 atom C
Disamping itu, diketahui bahwa massa molekul relatif gas oksigen adalah 32 dan massa atom relatif karbon adalah 12. Berdasarkan informasi ini, tampak adanya hubungan yang teratur antara massa zat dalam satuan gram, massa atom relatif atau massa molekul relatir, dan jumlah partikel zat itu. Untuk lebih jelas perhatikan tabel berikut.
| Zat | Massa (gram) | Jumlah Partikel | Ar atau Mr |
| O2 | 32,00 | 6,02 x 1023 molekul O2 | 32,00 |
| C | 12,00 | 6,02 x 1023 atom C | 12,00 |
| He | 3,99 | 6,02 x 1023 atom C | 3,99 |
Data pada tabel di atas dapat dibaca sebagai berikut
- Satu mol setiap zat sama dengan massa zat yang jumlahnya sebanyak bilangan Ar (untuk atom) atau Mr (untuk molekul) zat yang bersangkutan.
- Nilai massa atom relatif (Ar) atau nilai massa molekul relatif (Mr) suatu zat menunjukan massa zat yang mengandung jumlah zat yang mengandung jumlah partikel sebanyak 6,02 x 1023 atau sebesar satu mol.
Dengan demikian dapat disimpulkan bahwa, massa (gram) suatu zat yang besarnya sama dengan massa atom relatif untuk zat berupa atom, atau sebesar masa molekul relatif untuk zat berupa molekul atau senyawa ionik, adalah besarnya massa (gram) untuk satu mol zat. Massa satu mol zat dinamakan massa molar, disingkat Mm. Simbol massa molar sebenarnya adalah Mm, namun seringkali digunakan simbol Mr, meskipun secara konsep adalah kurang tepat.
Hubungan antara massa, jumlah mol, dan massa rumus (Mr) suatu zat adalah:
Contoh soal massa molar
1. Berapa jumlah molekul O2 yang terdapat dalam 16 gram O2? Diketahui Mr O2 = 32.
Penyelesaian:
Massa molar O2 = 32 gr per mol
Jumlah mol oksigen = (16 gr O2) / (32 gr/mol O2) = 0,5 mol
Jumlah molekul O2 dalam 0,5 mol = 0,5 mol O2 x 6,02 x 1023 molekul per mol = 3,01 x 1023 molekul O2.
2. Sepotong besi beratnya 10 gram. Berapa mol besi tersebut?
Diketahui Ar Fe = 56
Penyelesaian:
Massa molar besi = Mm Fe = 56 gram per mol
Mol besi = 10 gr Fe / 56 gr per mol = 0,179 mol
Demikian tulisan mengenai massa molar, semoga bermanfaat ….
Artikel Terkait
- Introductions (Perkenalan)
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?
