BILANGAN OKSIDASI ATAU BILOKS
Bilangan oksidasi atau tingkat oksidasi adalah banyaknya elektron yang dilepas atau diterima dalam pembentukan suatu molekul atau ion. Nilai bilangan oksidasi dapat berharga positif atau negatif. Bilangan oksidasi lazim disingkat biloks (b.o). Beberapa atom hanya memiliki satu biloks, ada juga atom yang memiliki lebih dari satu biloks.
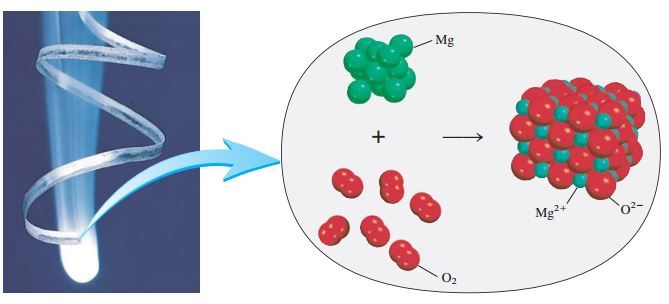
Mg bereaksi dengan Oksigen merupakan salah satu contoh reaksi redoks
Jika sobat menemukan bilangan oksidasi atom dalam suatu senyawa atau ion, sobat harus mengetahui lebih dahulu biloks atom unsur lainnya yang bersifat umum (standar). Berikut ini ketentuan-ketentuan unsur dalam penetapan biloks.
BILANGAN OKSIDASI ATAU BILOKS
-
Biloks unsur bebas dalam bentuk monoatomik, diatomik, triatomik, tetraatomik, dan seterusnya, memiliki harga nol.Contoh: Fe, C, H2, Cl2, F2, O2, P4, dan S8.
-
Bilangan oksidasi atom F adalaah -1.
-
Atom logam selalu memiliki bilangan oksidasi positif dengan harga sesuai dengan nomor golongannya, kecuali untuk logam transisi yang memiliki biloks lebih dari satu.
-
Biloks atom Li, Na, K, Rb, dan Cs adalah +1.
-
Biloks atom Be, Mg, Ca, Sr, Ba, dan Ra adalah +2.
-
Biloks atom Al adalah +3.
-
Biloks atom H umumnya adalah +1+, kecuali jika berikatan dengan unsur logam, seperti Na, bilangan oksidasi menjadi negatif (-1). Senyawa atom H dengan unsur logam disebut senyawa hidrida. Contoh: biloks H dalam senyawa Natrium hidrida (NaH) adalah -1.
-
Biloks atom O umumnya adalah -2, kecuali jika berikatan dengan atom F, atau dalam senyawaan peroksida dan superoksida. Bilangan oksidasi atom O adalah +2 dalam OF2, dalam senyawa peroksida (misalnya H2O2) berharga -1. Adapun dalaam senyawa superoksida (seperti KO2), biloks O bernilai -1/2.
-
Jumlah seluruh biloks atom-atom penyusun satu ion sama dengan muatan ion tersebut. Contoh biloks : S2- = -2; Fe3+ = +3; MnO4– = -1; dan Cr2O72- = -2.
-
Jumlah bilangan oksidasi unsur-unsur pembentuk senyawa netral sama dengan nol.
Contoh:
Muatan H2O= (2 x biloks H) + (1 x biloks O) = 0
= (2 x (+1)) + (1 x (-2)) = 0
Muatan KClO3 = (1 x biloks K) + (1 x biloks Cl) + (3 x biloks O) = 0
= (1 x (+1)) + (1 x (+5)) + (3 x (-2)) = 0
Muatan Al(OH)3 = (1 x biloks Al) + (3 x biloks O) + (3 x biloks H) = 0
= (1 x (+3)) + (3 x (-2)) + (3 x (+1)) = 0
Ingat! Jika semua unsur diatas saling bersaing maka gunakan prioritas beriku:
F > logam > H > O
Contoh soaal bilangan oksidasi
Tentukan biloks atom unsur yaang dicetak tebal dalam senyawa berikut.
-
N2O5
-
MnO4–
-
Cr2O72-
-
Na2S2O7
-
Al2(SO4)3
Jawab
Bilangan yang oksidasi akan ditentukan, misalkan x.
1. Muatan N2O5 = (2 x biloks N) + (5 x biloks O)
0 = (2x (x)) + (5 x (-2))
0 = 2x – 10
x = +5
Jadi, biloks atom N dalam senyawa N2O5 = +5
2. Muatan MnO4– = (1 x biloks Mn) + (4 x biloks O)
-1 = (1 x (x)) + (4 x (-2))
-1 = x – 8
x = +7
Jadi, biloks atom Mn dalam senyawa MnO4– = +7
3. Muatan Cr2O72- = (2 x biloks Cr) + (7 x biloks O)
-2 = (2 x (x)) + (7 x (-2))
-2 = 2x -14
x = +6
Jadi, biloks atomCr dalam senyawa Cr2O72- = +6
4. Muatan Na2S2O7 = (2 x biloks Na) + (2 x biloks S) + (7 x biloks O)
0 = (2 x (+1)) + (2 x (x)) + (7 x (-2))
0 = 2 + 2x -14
x = +6
Jadi, biloks atom S dalam senyawa Na2S2O7 = +6
5. Muatan Al2(SO4)3 = (2 x biloks Al) + (3 x biloks S) + (12 x biloks O)
0 = (2 x (+3)) + (3 x (x)) + (12 x (-2))
0 = 6 + 3x -24
x = +6
Jadi, biloks atom S dalam senyawa Al2(SO4)3 = +6.
Demikian tulisan mengenai ikataan kovalen koordinasi. Semoga bermanfaat….
Baca juga :
Cara Penyetaraan Reaksi Redoks dengan Cara Bilangan Oksidasi (Biloks)
Artikel Terkait
- Introductions (Perkenalan)
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?