Pengertian Isotop Beserta Contoh
Isotop adalah bentuk dari unsur yang nukleusnya memiliki nomor atom yang sama, tetapi jumlah proton di nukleus dengan massa atom yang berbeda karena mereka memiliki jumlah neutron yang berbeda.
Kata isotop, berarti di tempat yang sama, berasal dari fakta bahwa seluruh isotop dari sebuah unsur – unsur terletak di tempat yang sama dalam tabel periodik.
Secara bersama, isotop-isotop dari unsur-unsur membentuk suatu set nuklida. Sebuah nuklida adalah satu jenis tertentu nukleus atom, atau lebih umum sebuah aglomerasi proton dan neutron. Lebih tepat lagi untuk mengatakan bahwa sebuah unsur seperti fluorine terdiri dari satu nuklida stabil dan bukan dia memiliki satu isotop stabil.
Baca juga: Pengertian ISOTOP, ISOBAR, ISOTON Beserta Contoh
Dalam nomenklatur ilmiah, isotop (nuklida) dispesifikasikan berdasarkan nama unsur tertentu oleh sebuah hyphen dan jumlah nukleon (proton dan neutron) dalam nukleus atom (misal, helium-3, karbon-12, karbon-14, besi-57, uranium-238).
Dalam bentuk simbolik, jumlah nukleon ditandakan sebagai sebuah prefik naik-ke-atas terhadap simbol kimia (misal, 3He, 12C, 14C, 57Fe, 238U, dan lain-.lain).
Baca Juga: ISOTOP, ISOBAR, ISOTON
Semua atom dari unsur yang sama memiliki jumlah proton yang sama, tetapi beberapa mungkin memiliki jumlah neutron yang berbeda. Sebagai contoh, semua atom karbon memiliki enam proton, dan sebagian besar memiliki enam neutron juga. Tetapi beberapa atom karbon memiliki tujuh atau delapan neutron bukannya enam.
Atom dari unsur yang sama yang berbeda dalam jumlah neutron mereka disebut isotop. Banyak isotop terjadi secara alami. Biasanya satu atau dua isotop dari suatu unsur yang paling stabil dan umum. Isotop yang berbeda dari unsur umumnya memiliki sifat fisik dan kimia yang sama. Itu karena mereka memiliki jumlah yang sama dari proton dan elektron. Untuk penjelasan video tentang isotop, kunjungi URL ini:
Contoh: Isotop Hidrogen
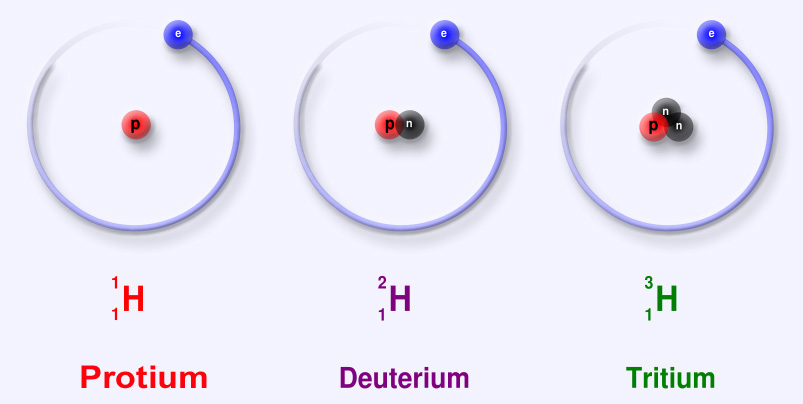
Hidrogen adalah contoh dari unsur yang memiliki isotop. Tiga isotop hidrogen dimodelkan pada Gambar di bawah. Kebanyakan atom hidrogen hanya memiliki satu proton dan satu elektron dan tidak memiliki neutron. Atom-atom ini hanya disebut hidrogen. Beberapa atom hidrogen memiliki satu neutron juga. Atom-atom ini adalah isotop bernama deuterium. Atom hidrogen lainnya memiliki dua neutron. Atom-atom ini adalah isotop bernama tritium.
Q: Jumlah massa atom adalah jumlah proton dan neutron. Berapa jumlah massa masing-masing isotop hidrogen yang ditunjukkan pada Gambar di atas?
A: nomor massa: hidrogen = 1, deuterium = 2, dan tritium = 3.
Penamaan Isotop
Bagi sebagian besar unsur selain hidrogen, isotop diberi nama sesuai nomor massa mereka. Misalnya, atom karbon dengan 6 neutron memiliki nomor massa 12 (6 proton + 6 neutron = 12), sehingga mereka disebut karbon-12. Atom karbon dengan 7 neutron memiliki massa atom 13 (6 proton + 7 neutron = 13). Atom-atom ini adalah isotop yang disebut karbon-13.
Q: Beberapa atom karbon memiliki 8 neutron. Apa nama isotop karbon ini?
A: atom karbon dengan 8 neutron memiliki massa atom 14 (6 proton + 8 neutron = 14), sehingga isotop karbon ini diberi nama karbon-14.
Baca juga: Kekhasan Atom Karbon
Stabilitas Isotop
Atom membutuhkan rasio neutron dan proton tertentu sehingga memiliki inti yang stabil. Memiliki terlalu banyak atau terlalu sedikit neutron relatif terhadap jumlah proton menghasilkan ketidak stabilan, atau radioaktif, sehingga inti cepat atau lambat akan terpecah ke bentuk yang lebih stabil. Proses ini disebut peluruhan radioaktif.
Banyak isotop memiliki inti radioaktif, dan isotop ini disebut sebagai radioisotop. Ketika mereka meluruh, mereka merilis partikel yang mungkin berbahaya. Inilah sebabnya mengapa isotop radioaktif yang berbahaya dan mengapa bekerja dengan mereka membutuhkan pakaian khusus untuk perlindungan. Isotop karbon dikenal sebagai karbon-14 adalah contoh radioisotop. Sebaliknya, isotop karbon yang disebut karbon-12 dan karbon-13 yang stabil.
Ringkasan
Atom dari unsur yang sama yang berbeda dalam jumlah neutron mereka disebut isotop. Isotop yang berbeda dari unsur umumnya memiliki sifat fisik dan kimia yang sama karena mereka memiliki nomor yang sama dari proton dan elektron.
Kebanyakan atom hidrogen kekurangan neutron dan hanya disebut hidrogen. Atom hidrogen dengan satu neutron adalah isotop yang dikenal sebagai deuterium, dan mereka isotop dengan dua neutron adalah bernama tritium.
Bagi sebagian besar unsur selain hidrogen, isotop diberi nama sesuai nomor massa mereka, yang merupakan jumlah proton ditambah neutron. Misalnya, karbon dengan nomor massa 14 disebut karbon-14.
Atom membutuhkan rasio tertentu antara neutron dan proton sehingga memiliki inti yang stabil. Jika mereka memiliki terlalu banyak atau terlalu sedikit neutron relatif terhadap proton, mereka merupakan radioaktif dan akan meluruh ke bentuk yang lebih stabil. Isotop dengan inti radioaktif disebut radioisotop.