Perbedaan Ikatan Kovalen dengan Kovalen Koordinasi
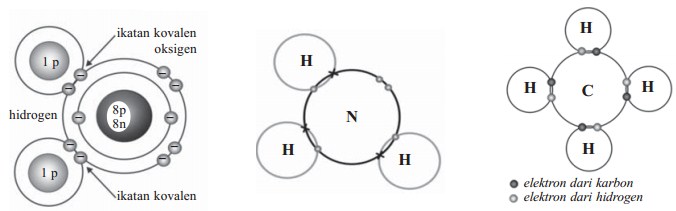
Terdapat dua istilah dalam ikatan kimia yang hampir sama yaitu ikatan kovalen dengan ikatan kovalen koordinasi. Selain kedua jenis ikatanyang hamper sama tersebut, juga terdapat ikatan-ikatan lainnya seperti ikatan ion dan ikatan logam.
Akan tetapi pada kesempatan ini kami secara khusus akan membagikan penjelasan mengenai perbedaan ikatan kovalen dengan ikatan kovalen koordinasi.
Untuk lebih jelasnya mengenai perbedaan keduanya, maka sahabat dapat menyimak penjelasan berikut dan tentunya disertai dengan contohnya masing-masing agar lebih mudah untuk dipahami.
Baca juga: 3 Jenis Ikatan Kimia (Ikatan Ion, Ikatan Kovalen dan Ikatan Logam)
Perbedaan Ikatan Kovalen dengan Kovalen Koordinasi
Ikatan Kovalen
Ikatan kovalen adalah ikatan yang terjadi akibat pemakaian pasangan elektron secara bersama-sama oleh dua atom (James E. Brady, 1990). Ikatan kovalen terbentuk di antara dua atom yang sama-sama ingin menangkap elektron (sesame atom bukan logam).
Cara atom-atom saling mengikat dalam suatu molekul dinyatakan oleh rumus bangun atau rumus struktur. Rumus struktur diperoleh dari rumus Lewis dengan mengganti setiap pasangan elektron ikatan dengan sepotong garis. Misalnya, rumus bangun H2 adalah H – H.
Dua atom dapat membentuk ikatan dengan sepasang, dua pasang, atau tiga pasang elektron bergantung pada jenis unsur yang berikatan. Ikatan kovalen yang hanya melibatkan sepasang elektron disebut ikatan tunggal (dilambangkan dengan satu garis), sedangkan ikatan kovalen yang melibatkan lebih dari sepasang elektron disebut ikatan rangkap.
Baca juga: Polarisasi Ikatan Kovalen Beserta Rumusnya
Ikatan yang melibatkan dua pasang elektron disebut ikatan rangkap dua (dilambangkan dengan dua garis), sedangkan ikatan yang melibatkan tiga pasang elektron disebut ikatan rangkap tiga (dilambangkan dengan tiga garis).
1. Ikatan Kovalen Tunggal
Contoh:
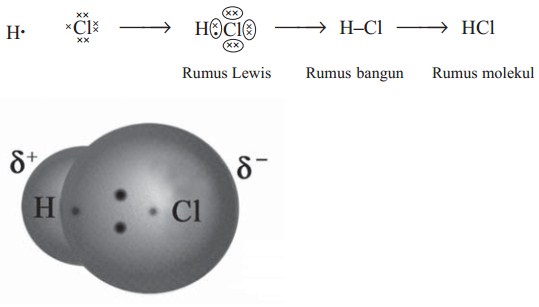
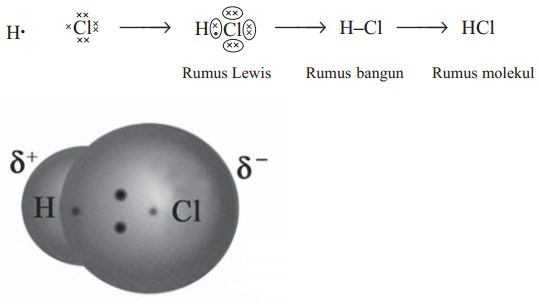
a. Ikatan antara atom H dan atom Cl dalam HCl
Konfigurasi elektron H dan Cl adalah:
H : 1 (memerlukan 1 elektron)
Cl : 2, 8, 7 (memerlukan 1 elektron)
Masing-masing atom H dan Cl memerlukan 1 elektron, jadi 1 atom H akan berpasangan dengan 1 atom Cl. Lambang Lewis ikatan H dengan Cl dalam HCl :
b . Ikatan antara atom H dan atom O dalam H2O
Konfigurasi elektron H dan O adalah:
H : 1 (memerlukan 1 elektron)
O : 2, 6 (memerlukan 2 elektron)
Atom O harus memasangkan 2 elektron, sedangkan atom H hanya memasangkan 1 elektron. Oleh karena itu, 1 atom O berikatan dengan 2 atom H. Lambang Lewis ikatan antara H dengan O dalam H2O :
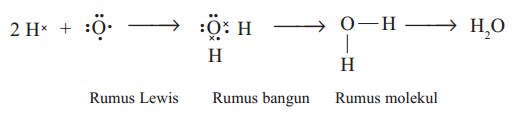
2. Ikatan Kovalen Rangkap Dua
Contoh:
Ikatan rangkap dua dalam molekul oksigen (O2)
Oksigen (Z = 8) mempunyai 6 elektron valensi, sehingga untuk mencapai konfigurasi oktet harus memasangkan 2 elektron. Pembentukan ikatannya serta lambing Lewis ikatan O2 dapat digambarkan sebagai berikut.
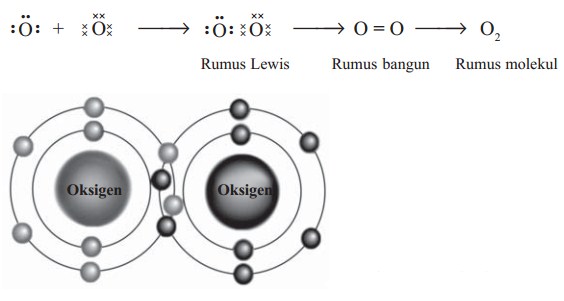
3. Ikatan Kovalen Rangkap Tiga
Contoh:
Ikatan rangkap tiga dalam molekul N2
Nitrogen mempunyai 5 elektron valensi, jadi harus memasangkan 3 elektron untuk mencapai konfigurasi oktet. Pembentukan ikatannya serta Lambang Lewis ikatan N2 dapat digambarkan sebagai berikut.
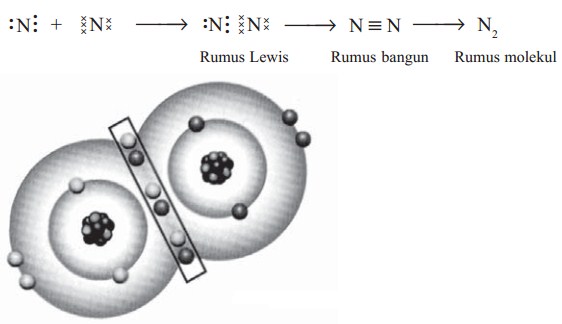
Pasangan elektron yang dipakai bersama-sama disebut pasangan elektron ikatan (PEI), sedangkan yang tidak dipakai bersama-sama dalam ikatan disebut pasangan elektron bebas (PEB). Misalnya:
- Molekul H2O mengandung 2 PEI dan 2 PEB
- Molekul NH3 mengandung 3 PEI dan 1 PEB
- Molekul CH4 mengandung 4 PEI dan tidak ada PEB
|
|
| Ikatan kovalen pada H2O, NH3, dan CH4 |
Ikatan Kovalen Koordinasi
Ikatan kovalen koordinasi adalah ikatan kovalen di mana pasangan elektron yang dipakai bersama hanya disumbangkan oleh satu atom, sedangkan atom yang satu lagi tidak menyumbangkan elektron. Ikatan kovalen koordinasi hanya dapat terjadi jika salah satu atom mempunyai pasangan elektron bebas (PEB).
Contoh:
Atom N pada molekul amonia, NH3, mempunyai satu PEB. Oleh karena itu molekul NH3 dapat mengikat ion H+ melalui ikatan kovalen koordinasi, sehingga menghasilkan ion amonium, NH4+. Dalam ion NH4+ terkandung empat ikatan, yaitu tiga ikatan kovalen dan satu ikatan kovalen koordinasi.
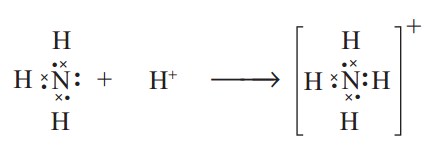
Kesimpulan Perbedaan Ikatan Kovalen dengan Kovalen Koordinasi
Ikatan kovalen merupakan ikatan kimia yang terjadi akibat pemakaian pasangan elektron secara bersama-sama oleh dua atom, sedangkan ikatan kovalen koordinasimerupakan ikatan kimia di mana pasangan elektron yang dipakai bersama hanya disumbangkan oleh satu atom, sedangkan atom yang satu lagi tidak menyumbangkan elektron.
Jadi ada beberapa hal yang dapat diperhatikan dari penjelasan di atas sebagai dasar yang menjadi perbedaan ikatan kovalen dengan ikatan kovalen koordinasi. Demikian dan semoga bermanfaat bagi kita semua.
Artikel Terkait
- Introductions (Perkenalan)
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?