MEKANISME REAKSI
Mekanisme reaksi membicarakan sederetan tahap dari suatu reaksi kimia, yang disebut tahap elementer, yang berguna juga untuk menentukan permsaan hukum laju. Berikut penjelasannya.
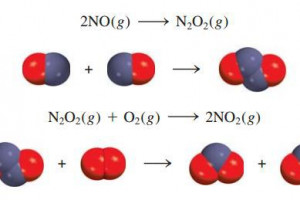
Seperti telah disebutkan terdahulu, persamaan kimia yang sudah sepenuhnya setara tidak memberi informasi banyak tentang bagaimana reaksi sesungguhnya terjadi. Dalam banyak kasus, persamaan ini sekedar menyatakan jumlah dari sederet reaksi sederhana yang sering dinamakan tahap elementer (elementary steps, atau reaksi elementer) karena reaksi-reaksi sederhana tersebut merepresentasikan jalannya reaksi keseluruhan pada tingkat molekul. Urutan tahap-tahap elementer yang mengarah pada pembentuk produk dinamakan mekanisme reaksi (reaction mechanism). Sebagai contoh mekanisme reaksi,mari kita lihat reaksi antara nitrogen oksida dan oksigen:
2NO(g) + O2(g) → 2NO2(g)
Kita mengetahui bahwa produk tidak terbentuk langsung dari tumbukan dua molekul NO dengan satu molekul O2 karena N2O2 terdeteksi selama jalannya reaksi. Anggaplah bahwa reaksi sebenarnya berlangsung dalam dua tahap elementer seperti berikut:

Pada tahap elementer pertama, dua molekul NO bertumbukan membentuk satu molekul N2O2. Peristiwa ini diikuti dengan reaksi antara N2O2 dan O2 yang menghasilkan dua molekul NO2. Persamaan kimia total, yang menyatakan keseluruhan perubahan, dinyatakan dengan menjumlahkan tahap elementer 1 dan 2:

Spesi seperti N2O2 disebut zat antara (intermediate) karena spesi-spesi itu muncul dalam mekanisme reaksi (yaitu tahap elementer) tetapi tidak dalam persamaan reaksi setara. Perlu diingat bahwa zat antara selalu terbentuk di awal tahap elementer dan terpakai dalam tahap elementer berikutnya.
Banyaknya molekul yang bereaksi dalam tahap elementer menentukan molekularitas reaksi (molecularity of a reaction). Setiap tahap elementer yang baru dibahas disebut reaksi bimolekular (bimolekular reaction), yaitu tahap elementer yang melibatkan dua molekul. Reaksi unimolekular (unimolecular reaction) adalah reaksi yang tahap elementernya hanya melibatkan satu molekul yang bereaksi.
Hanya ada sedikit reaksi termolekular (termolecular reaction), yaitu reaksi yang melibatkan tiga molekul dalam satu tahap elementer, yang diketahui. Alasannya, adalah bahwa dalam reaksi termolekular, produknya terbentuk sebagai akibat tumbukan tiga molekul secara serentak, yang kecenderungan terjadinya jauh lebih kecil dibandingkan peristiwa tumbukan bimolekular.
Dengan mengetahui tahaap elementer suatu raksi, kita dapat menentukan hukum laju. Misalkan kita mengikuti tahap elementer unimolekular berikut:
A → produk
Karena ini adalah proses yang terjadi pada tingkat molekul, semakin banyak molekul A yang ada, semakin cepat laju pembentukan produk. Jadi kita dapat menuliskan hukum laju secara langsung berdasarkan tahap elementer:
Laju = k [A]
Untuk tahap bimolekular yang melibatkan molekul A dan B:
A + B → produk
Laju pembentukan produk bergantung pada seberapa sering A dan B bertumbukan, yang juga bergantung pada konsentrasi A dan B. Dalam hal ini kita dapat menuliskan hukum laju sebagai:
Laju = k [A] [B]
Sama halnya, untuk tahap elementer bimolekular dengan jenis
A + A → produk
Atau
2A → produk
Hukum lajunya menjadi
Laju = k [A]2
Contoh-contoh ini menunjukan bahwa orde reaksi untuk setiap reaktan dalam tahap elementernya sama dengan koefisien stoikiometrinya di dalam reaksi kimia untuk tahap itu. Sebaliknya, kita tidak dapat mengetahui hanya dengan melihat persamaan reaksi setara saja apakah reaksi berlangsung seperti yang ditunjukan atau dalam sederetan tahap elementer. Penentuan ini dilakukan dilaboratorium.
Studi mengenai mekanisme reaksi melalui percobaan dimulai dengan pengumpulan data (pengukuran laju). Kemudian,kita analisis data tersebut untuk menentukan konstanta laju dan orde reaksi, dan kita tuliskan hukum lajunya. Akhirnya,kita ajukan mekanisme yang betul untuk reaksi tersebut berdasarkan tahap elementernya. Uraian tahap dalam mengkaji mekanisme reaksi kurang lebih:
Mengukur laju reaksi → Merumuskan hukum laju → mempostulatkan mekanisme reaksi yang masuk akal
Tahap elementer harus memenuhi dua syarat:
- Jumlah tahap elementer harus menghasilkan persamaan reaksi yang setara.
- Tahap penentu laju, yaitu tahap yang paling lambat dariseluruh rangkaian tahap menuju pembentukan produk, harus memprediksi hukum laju yang sama seperti yang ditentukan secara percobaan.
Satu analogi untuk tahap penentu laju adalah arus lalu lintas pada jalan yang sempit. Dengan anggapan mobil tidak dapat saling mendahului di jalan itu, laju mobil yang bergerak ditentukan oleh mobil yang geraknya paling lambat. Perlu diingat bahwa untuk setiap skema reaksi yang diajukan,kita harus mampu mendeteksi keberadaan setiap zat antara yang terbentuk dalam satu atau lebih tahap elementer.
Penguraian hidrogen peroksida memperjelas mekanisme reaksi berdasarkan percobaan ini. Reaksi ini dibantu oleh ion iodin. Reaksi keseluruhannya adalah:
2H2O2(aq) → 2H2O(l) + O2(g)
Dari percobaan, hukumlajunya adalah
Laju = k [H2O2]] [I–]
Jadi, reaksinya adalah orde pertama baik terhadap H2O2 maupun I–.Anda dapat melihat bahwa penguraian tidak terjadi dalam satu tahap elementer seperti dalam persamaan reaksi setara nya. Jika ya, reaksinya adalah reaksi orde kedua untuk H2O2 (perhatikan koefisien 2 dalam persamaan). Selain itu ion I–, yang bahkan tidak ada dalam persamaan keseluruhan, muncul dalam rumus hukum laju. Bagaimana kita bisa menjelaskan kenyataan ini?
Kita dapat menjelaskan hukum laju yang teramati dengan menganggap bahwa reaksi berlangsung dalam dua tahap elementer yang terpisah, masing-masing adalah reaksi bimolekular:
.jpg)
Jika kita asumsikan lagi bahwa tahap1 adalah tahap penentu laju, maka laju reaksi dapat ditentukan dari tahap pertama saja:
Laju = k1 [H2O2] [I–]
dimana k1 = k. Perhatikan bahwa ion IO– adalah zat antara karena ion ini tidak muncul dalam persamaan keseluruhan, I– berbeda dari IO– karena ion I– ada pada awal reaksi dan pada akhir reaksi. Fungsi I– adalah untuk mempercepat reaksi, dengan kata lain, I– adalah katalis. Kita akan membahas katalis di lain kesempatan. Akhirnya perhatikan bahwa jumlah tahap 1 dan 2 menghasilkan persamaan reaksi yang setara.
Demikian tulisan menngenai mekanisme reaksi. Semoga bermanfaat …..
Artikel Terkait
- Setiap Unsur Mampu Membentuk Ikatan Kimia Karena Memiliki...
- Lapisan Tanah Yang Paling Banyak Mengandung Materi Organik Adalah....
- Seekor Burung Terbang dengan Kelajuan 25 m/s. Bila Massa Burung Tersebut Adalah 200 gram. Maka Hitunglah Energi Kinetik yang Dimiliki Burung!
- Kalsium Mempunyai Nomor Atom 20 dan Nomor Massa 40. Jumlah Proton yang Terdapat Dalam Atom Kalsium Adalah ….
- Sinopsis Drama Korea Queen of Tears, Kisah Cinta, Intrik, dan Kejutan yang Mengharukan
- Produk Berikut yang Dibuat Dengan Bantuan Bakteri Adalah ....
- Jumlah Maksimum Elektron Pada Kulit N Adalah ...
- Sifat Fisika yang Dipengaruhi Oleh Perbedaan Massa Atom Partikel Penyusunnya Adalah...
- Sinopsis Drama Korea My Man is Cupid dengan Chemistry Mengagumkan antara Jang Dong-yoon dan Nana
- Rata-rata Ulangan Matematika di Suatu Kelas Adalah 78,4, Sedangkan Simpangan Standarnya 1,5. Jika Andi Adalah Salah Satu Siswa Kelas Tersebut