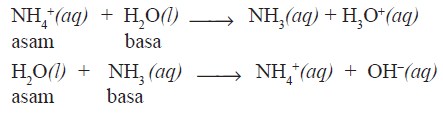Teori Asam Basa : Arrheniuss, Bronsted-Lowry, dan Lewis
Otakers, sebelum kita membahas secara lebih detail tentang Teori Asam Basa Lewis yang diutarakan oleh Ahli Kimia Amerika Serikat, bernama Gilbert Newton Lewis (23 Oktober 1875 – 23 Maret 1946) maka ada baiknya bagi kalian untuk mengetahui Pengertian Asam dan Basa itu sendiri.
Karena Pengertian Asam Menurut Ilmu Kimia memiliki artian sebuah Senyawa Kimia (Zat) yang dapat dilarutkan didalam Air dan akan menghasilkan Laruhan dengan pH yang lebih kecil dari 7 dan yang dapat memberikan Proton (ion H+) kepada Zat lain atau Senyawa Lain yang disebut dengan Basa. Sedangkan didalam Pengertian Basa menurut Ilmu Kimia adalah Zat (Senyawa Kimia) yang dapat beraksi dengan Asam, memberikan Senyawa yang disebut Garam dan Zat – Zat tersebut dapat menetralkan Asam.
Untuk Zat (Senyawa Kimia) Asam dan Basa ini saling berlawanan dan keduanya pun sering kita jumpai di kehidupan Manusia setiap harinya karena Zat (Senyawa Kimia) Asam ini ada didalam Cuka, Jeruk, Minuman Bersoda dan lain lain. Sedang Basa ada didalam Sabun, Bahan Pembuatan Pupuk dan lain lain. Oleh karena sangat baik sekali bagi kalian para Siswa Siswi untuk mengetahui secara lebih dalam tentang Zat (Senyawa Kimia) Asam dan Basa ini karena selain sering dijumpai di Kehidupan sehari – hari, Asam dan Basa tersebut pun sering muncul di Soal – Soal Ujian baik Ujian Sekolah atau Ujian Nasional di Mata Pelajaran Kimia.
Nahh perlu kalian tahu bahwa Teori Asam Basa dalam Ilmu Kimia telah terbagi menjadi 3 Teori Asam dan Basa yang antara lain Pertama Teori Asam Basa Arrhenius yang dikemukakan oleh Ahli Kimia Swedia bernama Svante August Arrhenius, Kedua Teori Asam Basa Bronsted Lowry yang dikemukakan oleh Dua Ahli Kimia yakni Jonannes Nicolaus Bronsted berasal dari Denmark dan Thomas Martin Lowry yang berasal dari Inggris serta yang ketiga ialah Teori Asam dan Basa Lewis yang dikemukakan oleh Ahli Kimia Asal Amerika Serikat yang bernama Gilbert Newton Lewis.
A. TEORI ASAM DAN BASA ARRHENIUS
Seperti yang telah disebutkan pada tulisan Asam Basa , Salah satu teori asam basa adalah teori Asam Basa Arrhenius. Menurut teori Asam basa Arrhenius , asam adalah zat yang dalam air melepaskaan ion H+ sedangkan basa adalah zat yang dalam air melepaskan ion OH-.

Svante Arrhenius (1887) menggemukakan bahwa asam adalah suatu zat yang jika dilarutkan ke dalam air akan menghasilkan ion hidronium (H+). Asam umumnya merupakan senyawa kovalen dan akan menjadi bersifat asam jika sudah larut dalam air. Sebagai contoh gas hidrogen klorida bukan merupakan asam, tetapi jika sudah dilarutkan ke dalam air akan menghasilkan ion H+. Reaksi yang terjadi adalah:
HCl(aq) → H+(aq) + Cl–(aq)
B. Asam dan Basa Menurut Bronsted-Lowry
Menurut Bronsted-Lowry menyatakan bahwa senyawa HCl bersifat asam karena dalam larutannya menghasilkan ion H+, sedangkan NaOH bersifat basa karena dalam larutannya melepaskan ion OH–. Teori asam-basa Arrhenius ini berlaku jika dalam keadaan berikut.
- Senyawa yang terlibat dalam reaksi harus dalam bentuk larutan.
- Suatu senyawa dikatakan bersifat asam jika dalam larutannya menghasilkan ion H+, sedangkan suatu senyawa dikatakan bersifat basa jika dalam larutannya melepaskan ion OH–.
Tetapi dalam kenyataan di alam ternyata ada fakta yang tidak mematuhi aturan Arrhenius tersebut, antara lain:
1. Gas HCl dan gas NH3 dapat langsung bereaksi membentuk NH4Cl.
HCl(g) + NH3(g) ⎯⎯→ NH4Cl(s)
2. Larutan Na2CO3 jika dites dengan indikator menunjukkan sifat basa padahal dalam senyawa tersebut tidak mengandung ion OH–.
Berdasarkan fakta di atas, maka dapat disimpulkan bahwa teori asam-basa Arrhenius belum bisa menjelaskan semua fenomena reaksi kimia. Oleh karena itu perlu ada teori asam-basa yang baru yang lebih mampu menjelaskan fenomena reaksi kimia.
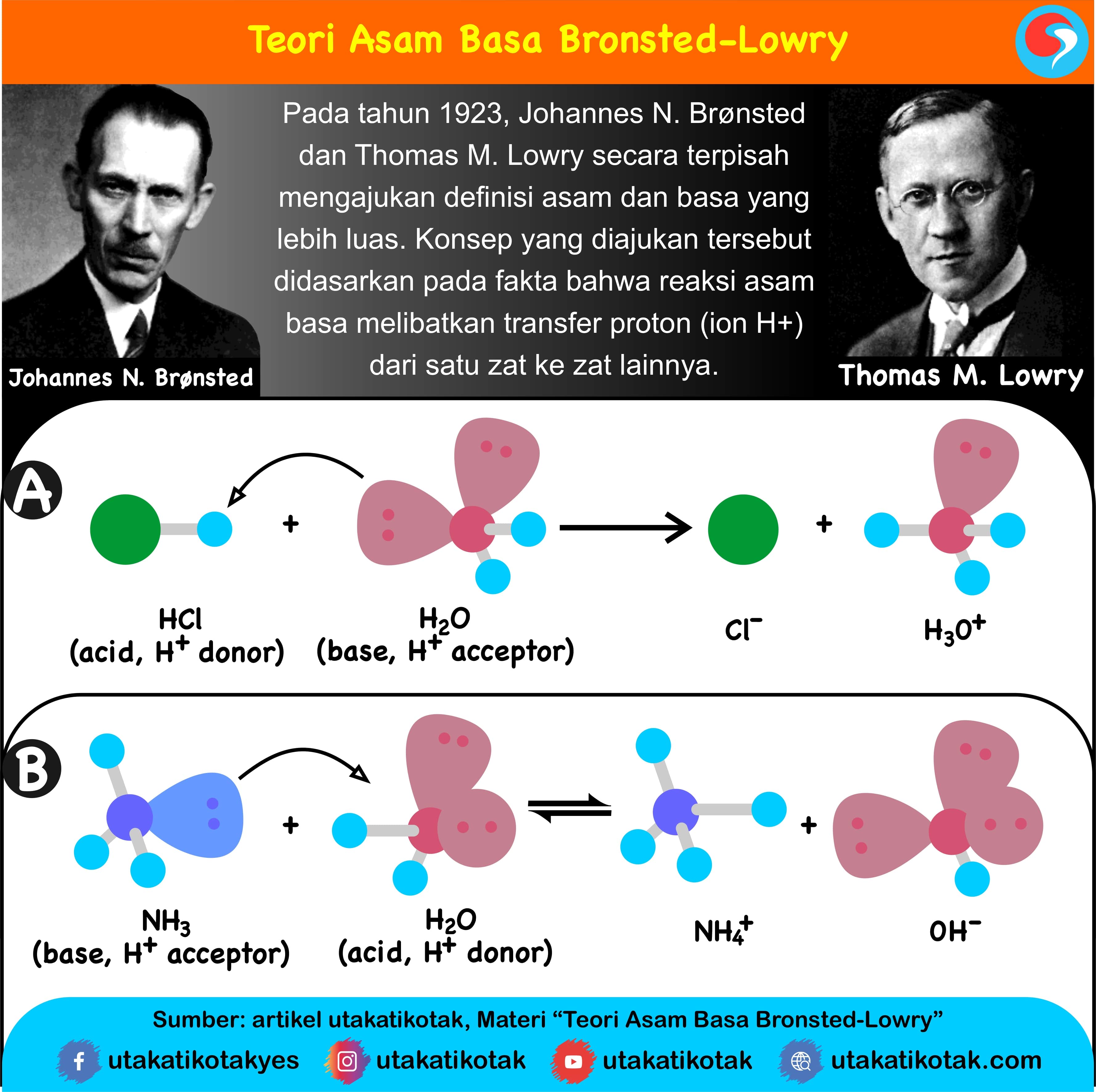
Menanggapi kekurangan teori asam-basa Arrhenius tersebut, pada tahun 1923, seorang ahli dari Denmark bernama Johanes N. Bronsted dan Thomas M. Lowry dari Inggris yang bekerja sendiri-sendiri, tetapi dalam waktu yang bersamaan mengembangkan konsep asam-basa berdasarkan serah-terima proton (H+). Konsep asam-basa berdasarkan serah-terima proton ini dikenal dengan konsep asam-basa Bronsted-Lowry.
Baca Juga :
Reaksi Asam Basa dan Reaksi Penetralan Dalam Kimia
Daftar Asam - Basa Kuat dan Lemah
Pengertian Asam dan Basa Menurut Bronsted-Lowry
Menurut Bronsted dan Lowry, asam adalah spesi yang memberi proton, sedangkan basa adalah spesi yang menerima proton pada suatu reaksi pemindahan proton.
- Asam Bronsted-Lowry = donor proton (H+)
- Basa Bronsted-Lowry = akseptor proton (H+)
Perhatikan contoh di bawah ini:
Pada contoh di atas terlihat bahwa air dapat bersifat sebagai asam (donor proton) dan sebagai basa (akseptor proton). Zat seperti itu bersifat amfiprotik (amfoter).
Perbandingan Konsep Asam-Basa
Konsep asam-basa dari Bronsted-Lowry ini lebih luas daripada konsep asam-basa Arrhenius karena hal-hal berikut.
- Konsep asam-basa Bronsted-Lowry tidak terbatas dalam pelarut air, tetapi juga menjelaskan reaksi asam-basa dalam pelarut lain atau bahkan reaksi tanpa pelarut.
- Asam-basa Bronsted-Lowry tidak hanya berupa molekul, tetapi juga dapat berupa kation atau anion. Konsep asam-basa Bronsted-Lowry dapat menjelaskan sifat asam dari NH4Cl. Dalam NH4Cl, yang bersifat asam adalah ion NH4+ karena dalam air dapat melepas proton.
C. Teori Asam Basa Lewis Secara Lengkap
Lalu didalam Teori Asam Basa menurut Lewis ini bahwa Asam merupakan suatu Senyawa Kimia (Zat) yang bisa menerima Pasangan Elektron dari Senyawa (Zat) lain atau bisa dikatakan Akseptor pasangan Elektron, sedangkan Basa Menurut Teori Asam Basa Lewis ialah suatu Senyawa Kimia (Zat) yang bisa memberikan pasangan Elektron kepada Senyawa yang lain atau bisa dikatakan sebagai Donor pasangan Elektron.
Teori Asam Basa Gilbert Newton Lewis ini merupakan sebuah Teori Asam Basa yang mengembangkan Teori Asam dan Basa Menurut Bronsted Lowry karena teori ini mempunyai keterbatasan dan kelemahan seperti saat menjelaskan reaksi – reaksi yang melibatkan senyawa tanpa proton (H+). Gilbert Newton Lewis berpendapat bahwa masalah Teori Asam-Basa harus diselesaikan dengan landasan Teori Struktur Atom, bukan hanya berdasarkan hasil percobaan (Penelitian) saja.
Contoh Teori Asam Basa Lewis Yang Ada
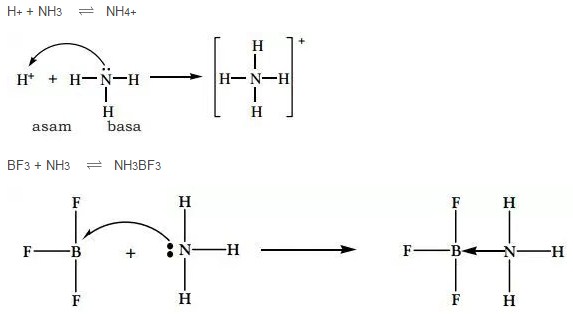
Contoh Teori Asam dan Basa Menurut Lewis pada Gambar diatas telah menunjukan bahwa Ion H+ (Proton) ialah Asam Lewis karena mampu menerima Pasangan Elektron, sedang NH3 merupakan Basa Lewis. Lalu pada reaksi antara BF3 dengan NH3 pada Gambar diatas yang merupakan Asam Lewis ialah BF3 karena bisa menerima sepasang Elektron dan teruntuk NH3 ialah Basa Lewis.
Untuk Kesimpulkan dari Perbedaan Teori Asam Basa Lewis dengan Bronsted Lowry adalah Teori Asam dan Basa Menurut Gilbert Newton Lewis lebih luas dan lengkap jika sepanjang yang dibahas didalamnya ialah Senyawa tanpa Proton, namun jika Reaksi Asam Basa yang melibatkan reaksi di Larutan dalam Air maka Teori Bronsted Lowrylah yang lebih mudah digunakan.
Artikel Terkait
- Setiap Unsur Mampu Membentuk Ikatan Kimia Karena Memiliki...
- Lapisan Tanah Yang Paling Banyak Mengandung Materi Organik Adalah....
- Seekor Burung Terbang dengan Kelajuan 25 m/s. Bila Massa Burung Tersebut Adalah 200 gram. Maka Hitunglah Energi Kinetik yang Dimiliki Burung!
- Kalsium Mempunyai Nomor Atom 20 dan Nomor Massa 40. Jumlah Proton yang Terdapat Dalam Atom Kalsium Adalah ….
- Sinopsis Drama Korea Queen of Tears, Kisah Cinta, Intrik, dan Kejutan yang Mengharukan
- Produk Berikut yang Dibuat Dengan Bantuan Bakteri Adalah ....
- Jumlah Maksimum Elektron Pada Kulit N Adalah ...
- Sifat Fisika yang Dipengaruhi Oleh Perbedaan Massa Atom Partikel Penyusunnya Adalah...
- Sinopsis Drama Korea My Man is Cupid dengan Chemistry Mengagumkan antara Jang Dong-yoon dan Nana
- Rata-rata Ulangan Matematika di Suatu Kelas Adalah 78,4, Sedangkan Simpangan Standarnya 1,5. Jika Andi Adalah Salah Satu Siswa Kelas Tersebut